Як утворюються розплави
Застигання магми - це процес росту кристалів з розплавів. При нагріванні тверді речовини розплавляються (якщо, звичайно, вони не згорають або не розкладаються на складові частини). Але виявляється, що кристали і аморфні речовини (скла) плавляться зовсім по-різному.
Кожне кристалічна речовина починає плавитися при абсолютно певній температурі. Нагріємо, наприклад, кристал олова і будемо при цьому вимірювати температуру: 100, 200, 220, 225 ° С - кристал не змінюється. Раптом при 231,9 ° С кристал починає плавитися. Скільки б разів ми не повторювали цей досвід, нам не вдасться розплавити кристал олова при 231 ° С або нижче, і, навпаки, нам не вдасться зберегти його при 232 ° С або вище - він обов'язково почне плавитися при 231,9 ° С, якщо тільки досвід проводиться при атмосферному тиску і в олові немає домішок.
І якщо немає явища переохолодження, про який мова піде нижче.
Будемо продовжувати нагрівати плавиться кристал олова. Незважаючи на нагрівання, температура олова більше не підвищується: у весь час плавлення вона залишається рівною 231,9 ° С. І тільки коли плавлення закінчиться, температура олова - тепер вже не кристала, а рідкого розплаву - почне підвищуватися, якщо, звичайно, продовжувати нагрівання .
Кристал кам'яної солі починає плавитися точно при 804 ° С, кристал кварцу-прі 1 470 ° С. Всі кристали плавляться при певній температурі, званої температурою плавлення. При цій температурі руйнується кристалічна структура, розпадається правильний лад частинок, як розсипається лад фізкультурників по команді «Розійтися!». Для всіх кристалів одного і того ж речовини при постійних умовах температура плавлення однакова, але для різних речовин вона різна. Всі кристали під час плавлення зберігають постійну температуру. Саме на цій властивості кристалів заснований пристрій термометра. Нуль градусів по стоградусной шкалі термометра - це температура, при якій в звичайних умовах тануть, тобто плавляться, кристали льоду.
А як же плавляться некристалічні тверді тіла? Нагріваючи якесь аморфне речовина, наприклад просте скло, ми вже не зуміємо визначити температуру, при якій воно починає плавитися, тому що аморфне речовина розплавляється поступово: воно розм'якшується, стає все менш і менш в'язким і врешті-решт зовсім рідким. Це і зрозуміло: адже тут не потрібно ніякої команди, щоб порушити лад, так як в склі всі частинки вже й до нагрівання розташовані безладно.
Якби скло плавилося відразу, як кристал, неможливо було б видувати і формувати з нього посуд. Лише завдяки тому, що скло розм'якшується або застигає поступово, склодув може видувати і ліпити його, надаючи йому будь-яку форму.
Наявність постійної температури плавлення відрізняє кристалічні тіла від некристалічних. Кристали починають плавитися відразу при певній температурі, а некрісталли (і суміші багатьох кристалічних речовин) розм'якшуються поступово - у них немає певної температури »плавлення. За цією ознакою можна відрізняти кристалічна речовина від некристаллического. Наприклад, лід починає танути при нулі градусів, значить, лід - це речовина кристалічна, а смола, асфальт, пластмаси, желатин, вар, столярний клей розм'якшуються поступово, - значить, ці речовини не кристалічні, а аморфні.
Але чи завжди однакова температура плавлення кристалів одного і того »ж речовини? Чи не можна змінити її? Виявляється, можна. Справа в тому, що температура плавлення кристала залежить від тиску, під яким цей кристал знаходиться. Наприклад, лід тане, тобто плавиться, при 0 ° С лише під нормальним тиском (в одну атмосферу). Якщо ж збільшувати тиск, то лід може розтанути і при меншій температурі, вже при декількох градусах морозу. Під тиском, що перевищує нормальний атмосферний тиск в 100 разів, лід тане при - 0,9 ° С, а якщо тиск в півтори тисячі разів більше атмосферного, лід розтане вже при -14,1 ° С.
Тиск впливає на температури плавлення у всіх кристалів, причому вплив це для різних речовин по-різному: у одних воно сильніше, в інших слабше; у деяких речовин при підвищенні тиску температура плавлення зростає, а у інших, навпаки, знижується. Це особливо позначається в глибині Землі, де діють тиску, в мільйони разів більші, ніж на її поверхні. Тому в надрах Землі кристали плавляться при інших температурах, ніж в лабораторіях. Але і там кристали починають плавитися обов'язково при певній температурі, тільки температура ця - особлива для кожної області тиску.
На температуру плавлення впливають, крім тиску, ще й інші причини, наприклад домішки інших речовин в розплаві. Так, наприклад, температури плавлення чистого заліза і чистого кремнію дуже високі, а суміш оксидів цих елементів з вапном плавиться при набагато нижчій температурі. На цьому заснований спосіб виплавки заліза з руд, що містять кремнезем. У рудню суміш додають вапняк; кремнезем, вапно та невелика частка заліза утворюють легкоплавкий шлак, який спливає і відділяється від більш тугоплавкого чистого заліза.
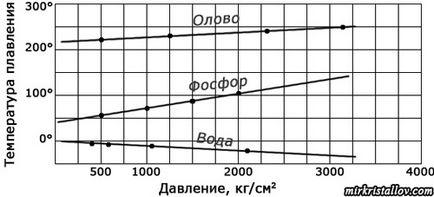
Залежність температури плавлення деяких речовин від тиску.
Якщо додати до льоду звичайну столову сіль, температура танення льоду сильно знизиться. Відомо, що солона морська вода замерзає при більш низькій температурі, ніж прісна. Суміш з однієї частини солі і трьох частин води тане ні до 0 °, а тільки при -23 ° С. Змішуючи лід з хлористим кальцієм, можна домогтися зниження температури до -55 ° С. Цим властивістю кристалів льоду користуються для приготування охолоджуючих сумішей: якщо посипати сіллю лід, наприклад, в морожениці, температура талого льоду різко знижується.