Загальна характеристика сірки
Сірка - шістнадцятий елемент Періодичної таблиці. Позначення - S від латинського «sulfur». Розташована в третьому періоді, VIа групі. Відноситься до неметалів. Заряд ядра дорівнює 16.
Сірка зустрічається в природі як у вільному стані (самородна сірка), так і в різних з'єднаннях. Дуже поширені сполуки сірки з різними металами. Багато з них є цінними рудами (наприклад, свинцевий блиск PbS, цинкова обманка ZnS, мідний блиск Cu2 S) і служать джерелом отримання кольорових металів.
З сполук сірки в природі також поширені сульфати, головним чином, кальцію і магнію, Нарешті, сполуки сірки містяться в організмах рослин і тварин.
Атомна і молекулярна маса сірки
Відносної молекулярна маса речовини (Mr) - це число, яке показує, у скільки разів маса даної молекули більше 1/12 маси атома вуглецю, а відносна атомна маса елемента (Ar) - у скільки разів середня маса атомів хімічного елемента більше 1/12 маси атома вуглецю.
Значення атомної і молекулярної мас сірки збігаються; вони рівні 32,059.
Аллотропия і аллотропние модифікації сірки
Сірка існує у вигляді двох аллотропних модифікацій - ромбічної і моноклінної.
При звичайних тисках сірка утворює тендітні кристали жовтого кольору, що плавляться при 112,8 o С; щільність дорівнює 2,07 г / см 3. Вона нерастворима в воді, але досить добре розчинна в сероуглероде, бензолі і деяких інших рідинах. При випаровуванні цих рідин сірка виділяється з розчину у вигляді жовтих кристалів ромбічної системи, що мають форму октаедрів, у яких зазвичай частина кутів або ребер як би зрізана (рис.1). Ця модифікація сірки називається ромбічної.
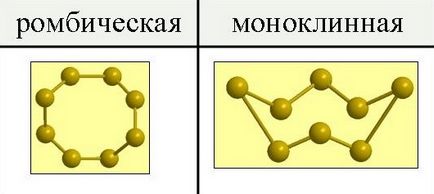
Мал. 1. Алотропні модифікації сірки.
Іншої форми кристали виходять, якщо повільно охолоджувати розплавлену сірку і, коли вона частково твердне, злити ще не встигла застигнути рідина. При цих умовах стінки судини виявляються покриті зсередини довгими темно-жовтими голчастими кристалами моноклінної системи. Ця модифікація сірки називається моноклінної. Вона має щільність 1,96 г / см 3. плавиться при 119,3 o С і стійка тільки при температурі вище 96 o С.
ізотопи сірки
Відомо, що в природі сірка може перебувати у вигляді чотирьох стабільних ізотопів 32 S, 33 S, 34 S і 36 S. Їх масові числа рівні 32, 33, 34 і 36 відповідно. Ядро атома ізотопу сірки 32 S містить шістнадцять протонів і шістнадцять нейтронів, а ізотопів 33 S, 34 S і 36 S- така ж кількість протонів, сімнадцять, вісімнадцять і двадцять нейтронів відповідно.
Існують штучні ізотопи сірки з масовими числами від 26-ти до 49-ти, серед яких найбільш стабільним є 35 S з періодом напіврозпаду рівним 87 діб.
На зовнішньому енергетичному рівні атома сірки є шість електронів, які є валентними:
1s 2 2s 2 2p 6 3s 2 3p 4.
В результаті хімічної взаємодії сірка може втрачати свої валентні електрони, тобто бути їх донором, і перетворюватися в позитивно заряджені іони або приймати електрони іншого атома, тобто бути їх акцептором, і перетворюватися в негативно заряджені іони:
S 0 -6e → S 6+;
S 0 -4e → S 4+;
S 0 -4e → S 2+;
S o + 2e → S 2.
Молекула і атом сірки
Молекула сірки одноатомних - S. Наведемо деякі властивості, що характеризують атом і молекулу сірки: