Спонсор конкурсу - далекоглядна компанія Life Technologies.
Все почалося з того, що в 20 столітті вчені зацікавилися природою незвичайних захворювань людини і тварин: куру. Крейтцфельда-Якоба. скрепі. Помітне схожість патології цих хвороб дало підставу для гіпотези про їх інфекційності, що згодом було експериментально підтверджено. Тоді виникло питання про збудника даних захворювань. Перш ніж була знайдена відповідь, були виявлені надзвичайні властивості збудників: вони не розмножуються на штучних поживних середовищах, стійкі до високої температури, формальдегіду, різних видів випромінювань, дії нуклеаз. Очищення інфекційного матеріалу і його вивчення дозволило проголосити про те, що «в усьому винен» білок, який 30 років тому отримав назву прион (від англ.pr [otenacious infect] ion - білкова інфекція).
Малюнок 1. Метафора нейродегенератівного ураження мозку - це губка, в яку перетворюється нервова тканина в результаті масової загибелі нейронів.
Біологічна сутність пріонів
Молекула приона не є чимось екзотичним: у «нормальної» формі вона є на поверхні нервових у кожного з нас. При цьому ми чудово себе почуваємо, і наші нервові клітини живі і здорові. Однак це все до тих пір, поки наш нормальний білок не «переродиться» в аномальну форму. А якщо це трапиться, то приведе до жахливих наслідків: інфекційна форма пріонів має властивість «склеюватися» з іншими молекулами і, мало того, «конвертувати» їх в цю ж саму форму, викликаючи «молекулярну епідемію». В результаті цієї полімеризації на нервовій клітині з'являються токсичні білкові бляшки *, і вона гине [1]. На місці загиблої клітини утворюється порожнеча - вакуоль, заповнена рідиною. З плином часу буде зникати один нейрон за іншим, а в мозку - утворюватися все більше «дірок», поки, нарешті, мозок не перетвориться в губку (рисунок 1), за чим неминуче піде смерть.
* - Існує спрощене уявлення, що полімеризовані пріонні фібрили «протикають» нейрон, що викликає його загибель. Насправді це не зовсім так: попередні фибриллярной стадії сферичні агрегати пріонів також володіють токсичністю (по крайней мере, для хвороби Альцгеймера): «Альцгеймера нейротоксин: отруйні не тільки фібрили». - Ред.
Але як може нормальний природний білок (позначається PrP C) раптом стати патологічним (PrP Sc; Sc - від слова «scrapie»)? Що має статися? Як і в разі «звичайної» інфекції, для такої трансформації необхідна зустріч з молекулою інфекційного пріона. Існують два шляхи передачі цієї молекули: спадковий (за рахунок мутацій в гені, що кодує білок) і інфекційний. Тобто впровадження приона може статися несподівано - наприклад, при вживанні в їжу недостатньо добре прожареного або звареного м'яса (в якому має бути присутня форма PrP Sc), при переливанні крові, при трансплантації органів і тканин, при введенні гормонів гіпофіза тваринного походження.
І тоді відбувається дивна подія: нормальні молекули білка, контактуючи з патологічними, самі перетворюються в них, змінюючи свою просторову структуру (механізм трансформації залишається загадкою і до цього дня) [1]. Таким чином прион, як справжнісінький інфекційний агент, заражає нормальні молекули, запускаючи ланцюгову реакцію, руйнівну для клітини.
Деякі відомості про пріони
- Пріонних білок включає 254 амінокислотних залишку і «важить» 33-35 килодальтон [2];
- Ген, що кодує білок PrP, знайдений у людини, ссавців і птахів [1];
- Для повного знищення пріонів білка потрібна температура не менше 1000 градусів [1]!
- Можливо, пріони беруть участь в міжклітинному впізнаванні і клітинної активації [3];
- Не виключено, що функцією пріонів є придушення вікових процесів [3];
- При розвитку клінічних проявів поранених захворювань немає ні ознак запалення, ні змін в крові;
- Передбачається, що пріони беруть участь в розвитку шизофренії та міопатії;
- Механізм дії пріонів і їх перетворення з нормальної форми в патологічну залишається неясним.
Умови виникнення захворювань
Умови виникнення пріонових хвороб унікальні. Вони можуть формуватися за трьома сценаріями: як інфекційні, спорадичні і спадкові ураження. В останньому варіанті головну роль грає генетична схильність [2].
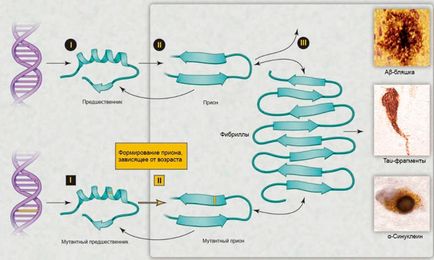
В останнє десятиліття інтерес до цієї теми відновився в зв'язку з можливістю розвитку діагностики і ефективної терапії [5]. З'явилося безліч різних пояснень для вікових нейродегенеративних хвороб, - наприклад, окислювальна модифікація ДНК, ліпідів і / або білків; соматичні мутації; змінений вроджений імунітет; екзогенні токсини; невідповідності ДНК-РНК; порушення роботи шаперонов; відсутність одного з алелей гена [5]. Альтернативним комплексним роз'ясненням служить те, що різні групи білків можуть формувати пріони. Незважаючи на те, що невелика кількість пріонів може бути видалено за допомогою шляхів білкової деградації, їх надмірне накопичення з плином часу дозволяє пріонами самостійно поширюватися в організмі (рис. 2), що призводить до порушення діяльності центральної нервової системи [5].
Групи ризику поранених захворювань
Ось кого пріонні захворювання можуть наздогнати з найбільшою ймовірністю:
- Працівники харчової промисловості;
- ветеринари;
- патологоанатоми;
- хірурги;
- Пацієнти трансплантолога;
- канібали;
- Особи, в сім'ї яких були помічені синдроми Герстманна-Штрейслера-Шейнклера або фатальною инсомнии.
Лабораторна діагностика та лікування
Діагностика базується на внутрішньомозковому зараженні мишенят або хом'яків, у яких повільно (до 150 днів) розвивається відповідне захворювання, якщо пацієнт був хворий [2]. Часто проводиться гістологічне дослідження головного мозку загиблих тварин [2].
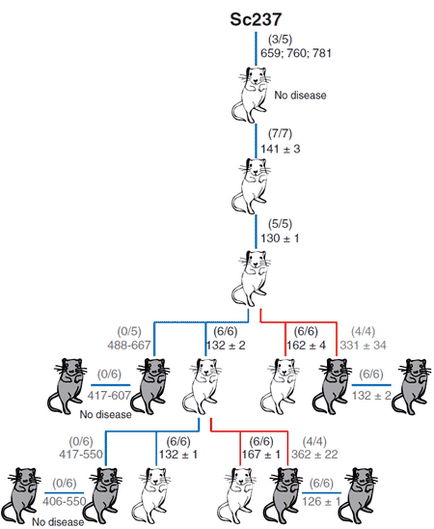
Малюнок 3. Здатність приона хом'яків Sc237 заражати і передаватися при введенні в мозок або селезінку трансгенним мишам, які мають пріонних білок PrP вівці (tg338; білі миші) або людини (tg7; сірі миші). Число хворих / ін'єктовані мишей показано в дужках; нижче наведено середній час життя (в днях). Малюнок з [6].
На жаль, до теперішнього часу ще не розроблені ефективні методи лікування пріонових хвороб, хоча спроби запобігти конформаційний перехід нормального білка в аномальний виробляються. Тому найнадійнішим способом попередження розвитку інфекційних форм є профілактика [2].
Особливо актуальним стає рішення «пріонів питання» в зв'язку з наростаючою загрозою виникнення епідемії через інвазивні медичні операції і навіть при прийомі лікарських засобів.
перспективи
Мабуть, інтерес до пріонів не згасне до тих пір, поки припущення стосовно них повністю не підтвердяться і не будуть знайдені ефективні способи лікування поранених захворювань. У статті [6] говориться про необхідність сучасного дослідження, яке вимагає ретельного розгляду чужорідних пріонів в екстраневрональних тканинах.
Чим викликана ця краща реплікація пріонів в лімфатичних тканинах, поки невідомо. Однак отримані дані показують, що людина може бути більш чутливим до чужорідних пріонами, ніж передбачалося раніше на підставі присутності пріонів в мозку, і з цієї причини безсимптомний переносник пріонів хвороби може бути визначено залежно від. Це ще раз підтверджує, що така могутня біомолекул як пріони таїть в собі чимало загадок, розкриття яких, можливо, допоможе в розумінні ряду нерозв'язних проблем людства.