Акумуляторні батареї
Принцип роботи свинцевого акумулятора
Джерелом електроенергії на автомобілі при непрацюючому або працює з малою частотою обертання колінчастого вала двигуні є акумуляторна батарея. В даний час на автомобілях найбільш широко застосовуються свинцеві акумуляторні батареї, що складаються з декількох послідовно з'єднаних акумуляторів. Застосування кислотних акумуляторів пояснюється тим, що вони мають невелику внутрішнім опором і здатні протягом короткого проміжку часу (кілька секунд) віддавати струм силою в кілька сотень ампер, що необхідно для живлення стартера під час пуску двигуна.
Свинцевий акумулятор електричної енергії був винайдений в 1859 році французьким фізиком Гастоном Планте. У наступні роки конструкція акумулятора, особливо - хімічний склад його електродів (пластин) постійно вдосконалювалася. В даний час свинцеві акумулятори та акумуляторні батареї широко застосовуються в різних областях техніки в якості накопичувачів електроенергії (стартерні батареї, аварійні і резервні джерела енергії і т. П.).
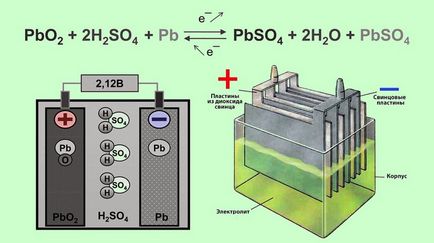
Конструктивно акумулятор являє собою ємність, наповнену електролітом, в якій розміщені свинцеві електроди. В якості електроліту використовується розчин сірчаної кислоти і дистильованої води. Електроди виконані у вигляді пластин, одна з яких виготовлена з губчастого свинцю Pb. а друга - з діоксиду свинцю PbO2. При взаємодії електродів з електролітом між ними виникає різниця потенціалів.
Принцип роботи свинцево-кислотних акумуляторів заснований на електрохімічних реакціях свинцю і діоксиду свинцю у водному розчині сірчаної кислоти.
При підключенні до електродів акумулятора зовнішнього навантаження починається електрохімічна реакція взаємодії оксиду свинцю і сірчаної кислоти, при цьому металевий свинець окислюється до сульфату свинцю.
Під час розряду відбувається відновлення діоксиду свинцю на позитивних пластинах (аноді) і окислення свинцю на негативному електроді (катоді). При пропущенні через електроди акумулятора зарядного струму в ньому протікають зворотні реакції. При перезаряді акумулятора, після вичерпання сульфату свинцю починається електроліз води, при цьому на аноді виділяється кисень, а на катоді - водень.
Електрохімічні реакції (зліва направо - при розряді, справа наліво - при заряді):
Реакції на аноді:
Реакції на катоді:
Фізичні процеси, що відбуваються в акумуляторі, пояснюються властивістю електролітичного розчинення металів, яке полягає в переході позитивно заряджених іонів металу в розчин. Легкоокисляющиеся метали (наприклад, свинець) володіють цією властивістю більшою мірою, ніж інертні метали.
При зануренні свинцевого електрода в розчин електроліту від нього почнуть відділятися позитивно заряджені іони свинцю і переходити в розчин, при цьому сам електрод буде заряджатися негативно.
У міру протікання процесу зростає різниця потенціалів розчину і електрода, і перехід позитивних іонів в розчин буде сповільнюватися.
При якоїсь певної різниці потенціалів електрода і розчину настане рівновага між силою електролітичної пружності розчинення свинцю, з одного боку, і силами електростатичного поля і осмотичного тиску - з іншого.
В результаті перехід іонів свинцю в електроліт припиниться.
При зануренні електроду, виготовленого з двоокису свинцю, в розчин сірчаної кислоти спостерігається такий же процес, але результат виходить інший. Двоокис свинцю в обмеженій кількості переходить в розчин, де при з'єднанні з водою іонізується на чотирьохвалентного іони свинцю РВ4 + і одновалентні іони гідроксилу ОН.
Чотирьохвалентного іони свинцю, осідаючи на електроді, створюють позитивний потенціал щодо розчину. Сірчана кислота утворює у воді практично тільки на іони Нo + і HSO4.
Таким чином, при розряді акумулятора витрачається сірчана кислота, утворюється вода, а на обох електродах - сульфат свинцю. При заряді процеси протікають у зворотному напрямку.
При підключенні споживачів в акумуляторі виникає розрядний струм. При цьому іони сірчанокислотного залишку SO4 з'єднуються зі свинцем електродів і утворюють на них сірчанокислий свинець PbSO4. а іони водню з'єднуються з киснем, виділяючись на позитивній пластині у вигляді води.
В результаті електроди покриваються сірчанокислим свинцем, а сірчана кислота розбавляється водою, т. Е. При розряді акумулятора щільність електроліту зменшується. Тому по щільності електроліту можна судити про ступінь зарядженості акумуляторної батареї.
По завершенню процесів відновлення свинцю на електродах заряд акумулятора припиняється. При подальшому проходженні електричного струму через електроліт починається процес електролізу (розкладання) води, при цьому акумулятор «закипає», і що виділяються бульбашки утворюють суміш водню і кисню. Суміш цих газів є вибухонебезпечною, тому слід уникати перезарядження до появи електролізних явищ з розкладання води.
Крім того, тривалий перезаряд призводить до втрати електролітом води (випару), в результаті чого його щільність підвищується і для коригування потрібно долівка дистильованої води.
При доливці води необхідно пам'ятати, що вода, яка потрапляє в концентровану сірчану кислоту, закипає і сильно розбризкує кислотні краплі, що при попаданні на відкрите тіло або одяг може привести до опіків шкіри, слизових оболонок, пропалення одягу та інших неприємних наслідків.
При постійній напрузі джерела зарядного струму в міру збільшення ступеня зарядженості акумулятора підвищується його ЕРС і, отже, зменшується сила зарядного струму. Коли напруга на клемах джерела струму дорівнюватиме ЕРС повністю зарядженого акумулятора плюс ЕРС поляризації, зарядний струм припиниться.
Середнє значення напруги акумулятора - 2 В. Оскільки електрообладнання сучасних автомобілів розраховане для роботи при напрузі в бортовій мережі 12 або 24 В. акумулятори з'єднують в батареї (по 6 або 12 шт.).
Важливим параметром акумулятора є його ємність, т. Е. Кількість електричної енергії, яку здатний віддати акумулятор. Ємність - це добуток сили розрядного струму на тривалість розрядки до гранично допустимого розрядженого стану. Вимірюється ємність акумулятора в ампер-годинах (А × год). Ємність акумулятора залежить, в першу чергу, від активної площі його електродів.
Тому підвищення ємності можна досягти збільшенням поверхні електродів, що досягається використанням декількох паралельно з'єднаних між собою пластин, а також застосуванням пористого матеріалу для їх виготовлення, що дозволяє використовувати в якості активної маси не тільки поверхню, але і внутрішній обсяг пластин.
Ємність акумулятора не постійна, вона залежить від сили розрядного струму, температури електроліту і стану активної поверхні пластин. При збільшенні розрядного струму і зниженні температури електроліту ємність акумулятора зменшується, що пояснюється неповним протіканням електрохімічних реакцій розрядки в цих умовах, внаслідок скорочення часу розрядки і підвищення в'язкості електроліту при низьких температурах.