З порівняння дипольних моментів зв'язків слід, що полярність зв'язку тим більше, чим більше різниця електронегативності утворюють зв'язок атомів.
Виняток становлять зв'язку C-OіC-S, C-FіC-Clіз через сильного збільшення довжини зв'язку при переході від елементів 2-го до елементів 3-го періоду:
1,1D <1,56D 1,83D <2,05D
Дипольні моменти кратних зв'язків більше, ніж відповідних ординарних:
Дипольні моменти кратних зв'язків
Висновок про направлення дипольного моменту можна зробити, виходячи з даних по електронегативності атомів-компонентів зв'язку: атом, що має меншу електронегативність, є позитивним кінцем диполя. Однак для сполучених (ароматичних) систем цього правила дотримуються не завжди.
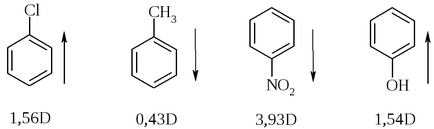
Значення дипольного моменту в напрямку лінії зв'язку можна використовувати для порівняльної якісної оцінки полярності зв'язків (відносної полярності).
Дробний або частковий заряд
У органічної хімії часто використовують поняття «частковий заряд», «дробовий заряд». Частковий заряд - це частка електрона, яка припадає на даний атом:
де L - меж'ядерних відстань (довжина ковалентного зв'язку), l - відстань між центрами одиничних зарядів в диполі, · e - величина самого часткового заряду.
Це співвідношення носить якісний характер, оскільки не враховує інкремент, внесений в дипольний момент зв'язку неподіленої парою електронів.
індуктивний ефект
Індуктивний ефект (цей же ефект в різних підручниках називають ще електронним або полярним) - це здатність заступника передавати свій вплив по ланцюгу ковалентно пов'язаних атомів. При цьому заступник також відчуває на собі вплив залишку молекули, до якого він приєднаний.
Передача впливу заступника по лінії σ- або -зв'язків призводить до зміни електронного стану цих зв'язків: відбувається їх поляризація, яка виявляється різною в залежності від типу зв'язку.
σ-зв'язку. Спостерігається поступове зменшення зміни електронного стану зв'язків:
Поляризація зв'язку між атомами хлору і вуглецю викликає індукційну (індуктивну) поляризацію сусідній зв'язку С-С; заступник при цьому проявляє -Iіндуктівний ефект. Найбільшою степеніI-ефект проявляється на сусідній до заступника зв'язку. З ростом ланцюга індукція швидко згасає.
-зв'язку. I -ефект полягає в полярізаціі-хмар. Має місце для ізолірованних-зв'язків.
Якщо заступник має іонні заряди або диполі, то електростатичне взаємодія може здійснюватися не тільки по лініях зв'язків, а й безпосередньо через простір або молекули розчинника. Такий вплив заступника називають ефектом поля (F-ефект). У багатьох випадках він важливіший, чемI-ефект. На близькій відстані обидва ефекту важко розділити, і найчастіше їх розглядають разом під загальною назвою «полярний ефект», «електронний ефект», або вживають терміни «індуктивний ефект», «ефект поля», маючи на увазі при цьому одночасне дію обох ефектів. Вплив замісників на віддалені положення (1,4 і більше) лише в незначній мірі передається по лінії зв'язків і в основному зводиться до впливу через простір.
Полярний ефект заступника є цілком певною величиною, міра його прояву залежить від структурних чинників, від наявності і природи інших заступників в молекулі, від розчинника та ін. Якісно оцінка I-ефекту проводиться шляхом порівняння впливу заступника на хімічні, фізико-хімічні, (константи іонізації ) або фізичні (дипольні моменти, ЯМР) властивості сполук за характером і величиною зі стандартним заступником - атомом водню: порівнюється досліджуване соедіненіеR-X (зі зв'язком С-Х) і стандартне соедіненіеR-H (Зі зв'язком С-Н). При цьому полярність зв'язку С-Н приймається рівною нулю, т. Е. Не береться до уваги її невеликий дипольний моментC-H = 0,2-0,4D.H- еталон, точка відліку; звідси виходить поняття про те що є донором, а що акцептором.
Якщо заступник порівняно з воднем збільшує електронну щільність по ланцюгу атомів (в тому числі зменшує наявні в ній під впливом інших атомів позитивні заряди), то він називається електронодонорності заступником (+ I-заступником) і проявляє + I-ефект.
Якщо заступник порівняно з воднем відтягує на себе електрони, і атоми ланцюга виявляються позитивно зарядженими (або відбувається зменшення негативного зарядженості ланцюга, якщо така була в ній до введення заступника), то він називається електроноакцепторні заступником (-I-заступником) і проявляє -I -ефект.
Насправді ні віддачі, ні захоплення електронів не відбувається, а мається на увазі просто різниця в положенні електронів зв'язку, сусідній до заступника, в порівнянні з водневим заступником:
Стандарт: H-CH2 -Ph
Якщо вплив заступника передається тільки по лініях зв'язків, то слід очікувати, що чим більше електронний торгівельний заступника. що знаходиться при вуглецевому атомі ланцюга, тим більше поляризація зв'язків і тим більше -I-ефект заступника:
Індуктивні ефекти різних груп по відношенню до водню
Напівкількісна оцінка індуктивних ефектів
1) Метод дипольних моментів. Але якщо заступники мають різні атоми з неподіленими парами, то цим методом користуватися не можна, так як
За значенням μнельзя зробити висновок про знак полярного ефекту.
2) Метод констант іонізації. Чим більше -I-ефект заступника, тим більше він делокалізует заряд в аніоні, тим стабільніше аніон і тим більше Ка (менше рКа).
Оцінка індукційних ефектів заступників по константам іонізації заміщених оцтових кислот
X-CH2 COOH X-CH2 COO + H
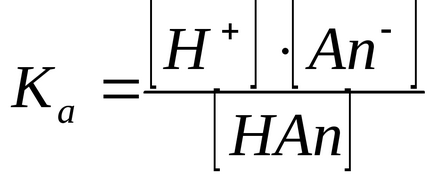
3) Метод спектроскопії ЯМР. Дозволяє оцінювати відносні значення позитивного заряду в молекулі СН3 Х: чим в більш слабке поле зрушать сигнал протонів метильної групи, тим більше дезекраніровано ядро, т. Е. Тим більше відтягнуті з нього валентні електрони. Дійсно, є хороша кореляція між хімічним зрушенням і електронегативні.
Порівняння заряджених і не заряджених заступників
Заряджені атоми (групи) виявляють сильніший -I-ефект, ніж незаряджені:
Негативно заряджені атоми (заступники) виявляють ефект протилежного знака в порівнянні з тими ж атомами (заступниками) в незарядженому стані:
У негативно зарядженого атома + I-ефект тим більше, чим менше його електронегативність, т. Е. Чим менше заряд ядра атома в періоді:
і чим більше заряд ядра і радіус атома в групі:
Для вуглеводневих (алкільних) груп + I-ефект зростає в ряду:
-I-ефект збільшується в тому ж ряду, в якому збільшується електронегативність гібрідізоваться вуглецю:
-I: sp 3 т. е. чим більше частка s-орбіталі, тим більше негативний індуктивний ефект. В цілому вплив заступників на стан σ-зв'язків зазвичай незначно і зазвичай в формулах спеціально не відображається.