Як відомо, до ішемії мозку призводить різке зниження рівня мозкового кровотоку або повна його зупинка. Ішемічні ушкодження мозку - це один з найбільш частих компонентів посттравматичного стану мозку.
J. Garsia з співавт. підкреслюють, що ішемія мозку буває глобальної або осередкової. У свою чергу, глобальна ішемія може бути незворотною, наростаючою і транзиторною (скороминущої).
Так, глобальна і необоротна ішемія мозку характерна для посмертного стану мозку. Глобальна наростаюча ішемія спостерігається в агональному стані. В результаті цих двох типів глобальної ішемії в мозковій тканині розвиваються аутолітіческіе процеси.
До транзиторною (скороминущої) глобальної ішемії мозку відносяться стану, що спостерігаються, наприклад, при клінічній смерті або інших випадках, в яких після тимчасової зупинки серця знову відновлюється кровообіг. Таким чином, глобальна транзиторная ішемія мозку може виникнути у випадках ЧМТ, що супроводжуються різким падінням артеріального тиску. Короткочасне задуха також є умовою розвитку глобальної транзиторної ішемії мозку.
Залежно від тривалості глобальної ішемії, в речовині мозку можуть проявитися різного ступеня вираженості дистрофічні, некробіотичні процеси аж до смерті мозку. Мікроскопічна характеристика смерті мозку - це відсутність ядерного фарбування, в першу чергу нейронів, слабка окрашиваемость мієлінових оболонок в і відсутність при цьому запальної реакції, збліднення еритроцитів.
Найбільш ранні пошкодження мозку спостерігаються в ділянках підвищеної чутливості до ішемії. Як відомо, в головному мозку існують ділянки, в яких в першу чергу розвиваються пошкодження при глобальній ішемії. Як правило, ці зміни виявляються в зоні стику кінцевих гілок артерій, в так званих зонах суміжного кровопостачання. Швидкість кровотоку в цих ділянках значно менше, ніж в інших ділянках мозку. Тому, навіть короткочасна зупинка кровотоку призводить до утворення стаза і сладжа еритроцитів з подальшим формуванням тромбу в цих судинах.
Як було вже зазначено вище, підвищеною чутливістю до глобальної ішемії мають клітини гіпокампу і клітини Пуркіньє мозочка.
Існує різниця в чувстітельность до ішемії навіть між різними верствами клітин кори мозку. Так, клітини III, IV і V шарів кори півкуль мозку більш чутливі до ішемії, ніж клітини I, II і VI шарів.
При одних і тих же умовах ішемії, нейрони в цілому, виявляються більш чутливими, ніж олигодендроглиоцитов і в ще більшому ступені, ніж астроцити.
Вогнищева ішемія мозку є наслідком порушення кровообігу в зоні кровопостачання однієї або декількох артерій. Оклюзія про- світла артерії, артеріоли або вени призводить до тривалої осередкової ішемії мозку і розвитку вогнища коагуляційного некрозу.
Нерідко причиною осередкової ішемії мозку ока- ни опиняються спазм однієї, двох або навіть несколь- ких артерій Вілізієва кола (рис. 5-57, 5 - 58). Так, інфаркт в зоні васкуляризації базиллярной артерії виявляється в 41,6% пацієнтів з діа- гностірованним доплерографією спазмом базиллярной артерії.
За даними доплерографії, посттравматичний вазоспазм починається на 2-5 день після травми і може захопити одну, дві або навіть всі артерії виллизиева кола. При цьому відзначають, що спазм артерій мозку після ЧМТ розвивається в більш ранні терміни, ніж вазоспазм після розриву аневризми. Причина цієї тимчасової різниці ще не відома.
До осередкової ішемії мозку веде тромбоз судин. Причиною тромбозу можуть бути: 1) різка гіпотензія, яка веде до стазу еритроцитів і сладжфеномену, переважно в ділянках уповільненої кровотоку (кінцеві гілки в зонах суміжного кровообігу); 2) механічне пошкодження стінки судини; 3) підвищене згортання крові; 4) ДВС-синдром.
Набряк стінок артеріол, внаслідок їх пошкодження або интрамурального крововиливи, звужує або обтуруючий їх просвіт може бути причиною ішемії мозку. Оклюзії просвіту венул, каплляров сприяє також периваскулярний набряк (набряк ніжок астроцитів) або перваскулярное крововилив.
Оклюзія периферичних ділянок мозкових артерій викликає вогнищевий дефіцит кровообігу і вогнищеві неврологічні симптоми, які швидко зникають, якщо вогнищева ішемія компенсується за рахунок колатералей менш ніж за 1-2 години.
Пероначальний неврологічний дефіцит відображає сублетальні пошкодження нейронів ділянки мозку, вимкненого повністю або частково з кровопостачання окклюзированной артерією. Неврологічний дефіцит і відповідно ушкодження нейронів стають незворотними. Якщо ішемія мозку триває більше ніж 60-120 хвилин, у відповідному зоні васкуляризації окклюзирована судини розвивається інфаркт мозку.
Макроскопічна характеристика інфарктів мозку.
Кордон між свіжим ішемічним інфарктом і перифокальною зоною мозку зазвичай буває важко помітна безпосередньо на аутопсії. При макроскопічному дослідженні на аутопсії вогнище ішемічного інфаркту добової давності не має чітких кордонів з перифокальною зоною. Набряк відповідного півкулі і можливо трохи більше в'яла консистенція речовини мозку в центральній частині вогнища ішемії дозволяє запідозрити інфаркт мозку. За подію 2-3 днів починають проступати кордону ішемізованої тканини. Перифокальний набряк зазвичай зникає через два тижні.
Ішемічні інфаркти становлять основну масу інфарктів мозку, можуть розвинутися в будь-якому відділі мозку і бути різної величини (рис. 5-59).
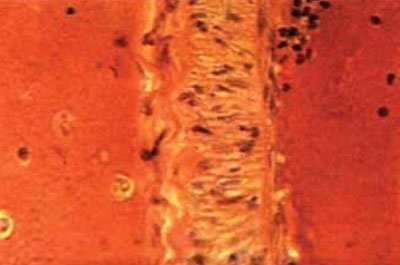
Мал. 5.57. Спазм артерії виллизиева кола, оповитою згортком крові: звивисті контури еластичної мембрани, часткова її фрагментація; перинуклеарной набряк в клітинах гладеньких м'язів, х200 (гематоксилін-еозин).
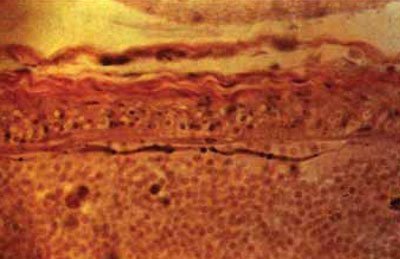
Мал. 5.58. Спазм артерії виллизиева кола: відшарування адвентициального шару, пернуклеарний набряк і різна щільність фарбування цитоплазми гладких клітин, фрагментація, звивисті контури еластичної мембрани, х200 (гематоксилін-еозин).
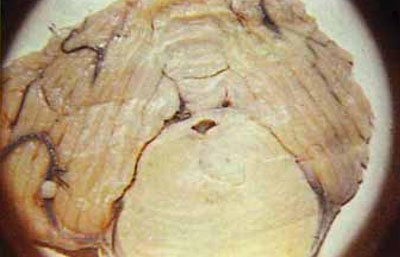
Мал. 5.59. Фронтальний зріз на рівні передньої третини моста. Осередок ішемічного інфаркту моста, який розвинувся в разі забиття скроневої частки.
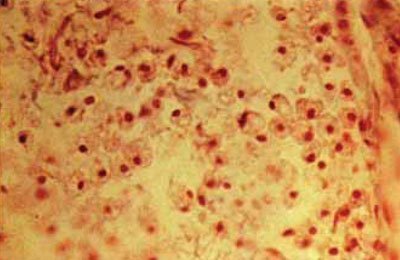
Мал. 5.61. «Зернисті кулі» - макрофаги в осередку лакунарного інфаркту мозку, х300 (забарвлення по Маллорі).
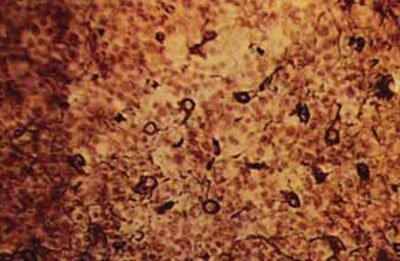
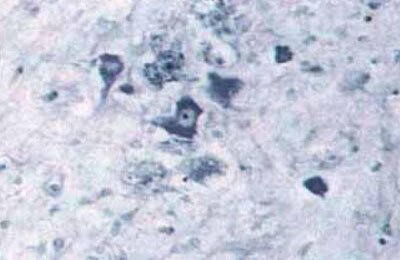
Мал. 5.63. Некроз нейронів в периферичних ділянках інфаркту мозку. Набухання, вакуолізація, лізис цитоплазми нейронів, деструкція ядра, х200 (забарвлення по Нісль).
Геморагічні інфаркти, зазвичай невеликих розмірів, розвиваються в сірій речовині. Причиною їх виникнення може бути оклюзія, як артерій, так і вен. Макроскопічно геморагічний інфаркт є вогнище в'ялої консистенції червоного кольору з чіткими межами (на відміну від крововиливів геморагічного типу). Чіткість кордонів зумовлена тим, що крововиливу передують некробиотические процеси в речовині мозку. Однак, обидва ці процеси зближені в часі на відміну від змішаного інфаркту.
Змішаний інфаркт - це ішемічний інфаркт з вогнищами крововиливів різної давності, що надає йому строкатий вигляд. Найчастіше виникають у великих півкулях мозку, досягаючи нерідко великих розмірів.
Лакунарні інфаркти є результатом оклюзії дрібних пенетрирующих артеріол. Розвиваються вони в базальних гангліях, внутрішній капсулі, подушці моста, в субкортікальной білій речовині. Розмір лакун зазвичай не перевищує 15-36 мм в діаметрі і залежить від калібру окклюзирована судини (рис. 5-60). Свіжі лакунарні інфаркти важко помітні і можуть залишитися непоміченими на зрізах мозку, вироблених безпосередньо під час аутопсії.
Мікроскопічна характеристика інфарктів мозку.
Експериментальна оклюзія інтракраніальних артерії призводить до утворення строкатого вогнища ішемії-гіперемії, який через 2-3 години зливається в один великий ділянку «інфаркту» мозку.
Зміни в структурах мозку, викликані оклюзією артерії, наростають поступово. На оглядових гістологічних препаратах, забарвлених гематоксиліном і еозином, перші ознаки пошкодження нейронів виявляються через 2-3 години. Вже через 3 години після оклюзії артерії виявляються три зони інфаркту - центральна, реактивна і перифокальная. Некробиотические процеси в нейронах наростають протягом перших 18-24 годин.
Як показали експериментальні дослідження, початок загибелі першої групи нейронів в зоні ішемії, збігається з початком дезінтеграції в олигодендроцитов. Астроцити, на відміну від нейронів, претерпевающих дегенеративні зміни, в перші 4-6 годин після початку ішемії, в цей проміжок часу виявляють навіть ознаки активації. Через 8-12 годин після оклюзії артерії, виявляється слабке фарбування мієлінової оболонки. Дезінтеграція мієлінової оболонки настає через 2-3 дня. Некроз ендотеліальних клітин чітко видно вже через 2 дні після оклюзії судини. Крайове стояння нейтрофілів в капілярах і венулах можна виявити вже через 12 годин після початку ішемії. Впровадження нейтрофілів в ділянку некрозу мозку починається через 24-36 годин. У цей час з'являються моноцити, які через 5-7 днів перетворюються в макрофаги (рис. 5-61) та новостворені судини вростають в осередок інфаркту (рис. 5-62).
Ще в роботах класиків нейроморфологии вказувалося, що через 4-8 тижнів після ЧМТ в корі не тільки ипсилатерального, але і контрлатерального півкулі мозку виявляються так звані «ішемічні» зміни нейронів (червоні нейрони). Вважали, що ці зміни нейронів з наступною їх загибеллю, є результатом тривалої гіпоксії мозку.
Дійсно, гістологічні докази гипоксического пошкодження нейронів гіпокампу та інших відділів головного мозку виявлені в 93% випадків ЧМТ з документованої гипоксемией. Дослідження морфології експериментальної ЧМТ також показали, що протягом перших тижнів після травми мозку, спостерігається відстрочена загибель нейронів в зоні суміжного кровопостачання, в гіпокампі і в зоровому горбі.
Так, в 84% аутопсії летальних випадків закритою черепно-мозкової травми було виявлено «випадання» нейронів або важкі їх пошкодження в зоні С-А-1 гіпокампу. З них, в 44% виявлені пошкодження нейронів і в зоні С-А-3 гіпокампу, що не володіє виборчої чутливістю до гіпоксії.
Узагальнивши результати серії досліджень, M. Kotapka з співавт. прийшов до висновку, що гіпоксія-гіпоксемія, що виникає внаслідок роз- особистих причин, таких як порушення дихальної функції, артеріальна гіпотензія, вплив екзотоксинів, порушення мозкового кровообігу і т.д. тільки частково впливає на виборчу загибель нейронів гіпокампу після ЧМТ. Такого роду спостереження показували, що, ймовірно, існують якісь інші механізми ушкодження нейронів, крім гіпоксії-ішемії.
В середині 90-х років роботами A. Rink c співавт. було отримано доказ, що причиною відстроченої загибелі нейронів, по крайней мере, на моделях експериментальної ЧМТ, є апоптоз цих клітин.
Термін «апоптоз» (опадає листя), багато дослідників використовують як синонім поняття «запрограмованої смерті клітини», тоді як ці терміни означають подібні, але не ідентичні процеси.
Генетично запрограмована смерть клітини є важливою складовою частиною інволюційних процесів в організмі (наприклад, вікова атрофія вилочкової залози), в оновленні популяції кровотворних елементів, епітелію шлунково-кишкового тракту і дихальних шляхів і т.д. і є результатом активації генетичної програми смерті, відповідно «біологічним годинником» кожної конкретної клітини.
Апоптоз - смерть клітини, індукованої ззовні, тобто «Суїцид, самогубство» клітини. У цих випадках загибель клітини починається з фрагментації ДНК, тобто руйнування її ядра.
Некроз клітини є пасивним процесом, результатом її «вбивства» зовнішніми по відношенню до клітки факторами. Загибель клітини при некрозі починається з цитоплазми і завершується фрагментацією ДНК. Морфологічна характеристика некрозу клітини полягає в набуханні, побледнении, збільшенні обсягу цитоплазми, лизисе її органел, руйнуванні клітинної мембрани (рис. 5-63).
Морфологічна характеристика апоптозу включає в себе конденсацію хроматину (рис. 5-64), розпад ядра з утворенням апоптотичних тілець (каріорексис), виражену внутрішньоядерних фрагментацію ДНК, еозинофілію і зменшення обсягу цитоплазми, в якій органели тривалий час залишаються інтактними.
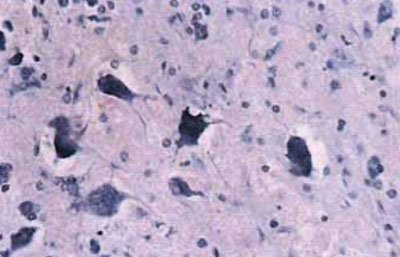
Мал. 5.64. Гіперхромія і зменшення площі цитоплазми, пикноз ядра нейронів в гіпокампі півкулі, контлатерального вогнища забиття, х200 (забарвлення по Нісль).
Здатність до повноцінної репарації ДНК, є умовою збереження нормального функціонування нейрона. У випадках хромосомної генної мутації збільшується можливість того, що репарація ДНК може піти з помилками. Дефектна репарація ДНК, яка призвела до нестабільності генома, може бути причиною сприяє запуску механізмів апоптозу.
Ці дані вже набувають і практичне значення. Використовувані в даний час в неврологічних клініках терапевтичні заходи спрямовані, в основному, на запобігання ішемічного коагуляційного некрозу і не враховують можливість загибелі нейронів, внаслідок апоптозу. Тоді як, доповнення лікування препаратами, що зменшують ризик розвитку апоптозу, може відкрити нові можливості в запобіганні або зменшенні посттравматичного пошкодження мозку.