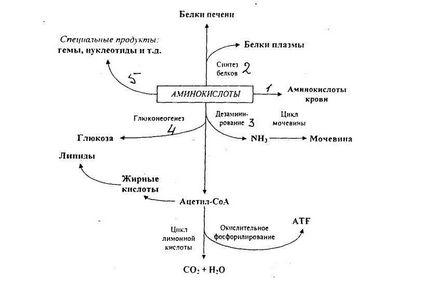
Цих шляхів п'ять:
- транспорт в інші тканини;
Амінокислоти з печінки можуть надходити в систему кровообігу і, таким чином, поставлятися в інші органи, а також використовуватися в якості структурних білків для біосинтезу тканинних білків.
- біосинтез білків печінки і плазма крові;
Білки печінки піддаються постійному оновленню, причому для них характерне дуже висока швидкість обороту із середнім періодом напіввиведення всього лише кілька днів. Крім того, саме в печінці синтезується більше білків плазми крові.
-дізамінірованіе і розпад;
Амінокислоти, які не були використані в печінці, піддаються дізамінірованію і розпадаються з утворенням ацетил-СоА і проміжних субстратів лимонної кислоти, останні можуть перетворюватися в глюкозу і глікоген шляхом глюконеогінеза. Ацетил-СоА або піддається окисленню в циклі лимонної кислоти, з накопиченням енергії запасається у формі АТФ, або перетворюється в ліпіди, які відкладаються в запас. Висвобождённие при розпаді амінокислоти і аміак перетворюються в сечовину, в ході протікає в печінці циклу сечовини.
Печінка бере участь так само в метаболізмі амінокислот вступників, час від часу, з периферичних тканин. Через кілька годин після кожного прийому їжі, з м'язів у печінку надходить аланин. У печінці він піддається дізамінірованію, а що утворюється піруват, в результаті глюконеогінеза, перетворюється в глюкозу крові. Глюкоза повертається в скелет м'язів для заповнення в них запасом глікогену. Одна з функцій циклічного обміну полягає в тому, що він пом'якшений коливанням рівня глюкози в крові в періодах між прийомами їжі. Виниклий в м'язах дефіцит, в подальшому, після їжі заповнюється за рахунок всмоктуваності амінокислот їжі.
-перетворення в нуклеотиди та інші продукти.
Амінокислоти служать попередниками в біосинтезі пуринових і піримідинових основ, нуклеотидів, а так само в синтезі деяких спеціальних речовин, зокрема порфиринов, гормонів та інших азотовмісних сполук.
Білки пов'язують воду, тобто проявляють гідрофільні властивості, при цьому вони набухають, збільшується їх маса і об'єм. Набухання білка супроводжується його частковим розчиненням. Гідрофільність окремих білків залежить від їх будови.
Завдяки наявності на поверхні білкових глобул, груп несучих позитивний або негативний заряд, навколо молекули білка утворюється гидратная оболонка, яка перешкоджає агрегації, а отже сприяє стійкості розчинів білка і перешкоджає їх осадженню. У ВЕТ білки мають найменшої здатністю пов'язувати
воду, відбувається руйнування гідратної оболонки, тому перетворюються великі агрегути білкових молекул. Агрегація білка відбувається і при зневодненні з допомогою деяких органічних розчинників. При зміні рН середовища макромолакули білка стають заряджені і його гідротаціонних здатність змінюється. При обмеженому набуханні концентровані білкові розчини утворюють складні системи звані холодцю. Вони не володіють плинністю, пружні, пластичні, володіють певною механічною міцністю і здатні зберігати свою форму. Глобулярні білки можуть повністю гидротірованний, розчиняючись у воді, утворюючи розчини з невисокою концентрацією, наприклад білки молока. Гідрофобні властивості білків, тобто їх здатність набухати, утворювати холодці, стабілізувати емульсії, суспензії і піни, має велике значення в біології і харчової промисловості при зберіганні і переробці зерна. випічці хліба, виробництва макаронних виробів і т.д.разлічная гідрофільність білків - один з найважливіших ознак зерна сильної і слабкої пшениці. Сильно гидротірованний холодцем є сира клейковина, виділена з пшеничного тіста. Вона містить до 65% води. Різна гідрофільність клейковини білків одна з ознак, що характеризують якість зерна і отриманої з нього муки.
Денатурація білків це складний процес при якому під впливом зовнішніх факторів відбувається зміна двійковій, третинної і четвертинної структури білкової макромолекули, тобто її нативной просторової структури. Первинна структура, а значить і хімічний склад балка не змінюються. Денатурація змінює початкові властивості білкових речовин. При цьому збільшується реактивність деяких хімічних груп, що входять до складу молекули, пояпляются вільні групи (сульфгідрильні та ін.), Зменшується розчинність, гідрофільність, ферментативна активність, змінюється форма або величина білкової молекули, збільшується її асиметрія, полегшується вплив на білки протеолітичних ферментів, а отже він легше гідролізуется.в харчової технології особливе практичне значення має теплова денатурація білків. Нагрівання викликає розрив водневих зв'язків і порушує взаємодію гідрофобних груп. Тепловаяденатурація білків найбільш часто спостерігається при сушінні зерна, якщо вона ведеться з порушенням встановлених правил, а також в результаті самозігрівання.
При нагріванні до схожість зерна не змінюється. При температурі знижуються хлібопекарські властивості, особливо зерна пшениці. Ступінь теплової денатурації залежить від температури, тривалості нагрівання і вологості. Це необхідно пам'ятати при розробці режимів термообробки харчової сировини, напівфабрикатів, а іноді і готових продуктів. Особливу роль в процесі теплової денатурації грає при бланшировании рослинної сировини, випічці хліба, отриманні макаронних виробів. Фізичні, хімічні і біологічні способи денатурації широко використовуються в харчовій промисловості і біотехнології.
Під цим процесом розуміють здатність білків утворювати високомолекулярні системи: рідина-газ. Такі системи називаються - піни. Стійкість піни в якій білок є піноутворювачем залежить не тільки від його природи, але також від концентрації і температури. Білки пенообразователи широко використовуються в кондитерській промисловості при виробництві пастили, зефіру. Вони грають важливу роль в утворенні піни і пеностойкости в готовому пиві. Структуру піни має хліб, і це впливає на його органолептичні властивості. Хороший хліб має структуру застиглої піни. Білкові розчини проявляють максимальну пенообразующую здатність, як правило, в ВЕТ, яка досягається в слабокислих середовищах. Для отримання пенообразующих кондитерських мас в якості стабілізаторів піни широке застосування отримали яєчні білки і молочно-білкові піноутворювачі. При при отриманні пастильних мас свіжий яєчний білок додають в кількості 1,5% до маси рецептурної сахарояблочной суміші. При цьому рН = 3,2-3,8. молочні білки в сильнокислому середовищах знижують пенообразующую здатність, тому вони використовуються лише при виготовленні кількох збитих цукеркових мас. Крім перерахованих важливі й інші технологічні властивості білків, наприклад використання їх як наповнювачів для різних напоїв, в тому числі газованих. Напої, збагачені білковими гідролізатами, наприклад соєвими, мають низьку калорійність і можуть зберігатися тривалий час навіть при відносно високих температурах без додавання консервантів.
Харчові алергії грають негативну роль для людини, виражаються в небажаних хворобливих реакціях (набряк, почервоніння і свербіж шкіри, утруднення дихання і т.д.) у відповідь на споживання білка одного або декількох харчових продуктів (найчастіше це полуниця, молоко, яйця). алергії є результатом індивідуальної підвищеної чутливості організму людини до певного речовини (алергену) в результаті попереднього контакту з цією речовиною. При попаданні в кров людини чужорідних клітин або молекул білків (антигенів) утворюються антитіла проти них. Однак, в ряді випадків при первинному попаданні в кров людини утворюються особливі так звані реагінові антитіла, які присутні не тільки в сироватці крові. Але і розташовуються на поверхні ряду вельми реактивних клітин як в крові так і в деяких тканинах. Реакції цих тіл зі вторинним надійшов в кров антигеном супроводжуються зміною структури та обміну речовин в цих клітинах, при цьому в них утворюються високоактивні речовини, які виділяються в кров і призводять до розвитку клінічної картини алергії. Харчова алергія може бути викликана не тільки харчовими білками, які є антигенами для організму людини, але і незвичайними низькомолекулярними сполуками, що потрапляють в їжу. Вони приєднуються до власних білків організму людини і перетворюють їх тим самим в чужорідні білки, які викликають відповідні імунологічні реакції в ряді випадків алергічної природи. Приєднання незвичайних низькомолекулярних сполук, які потрапили в їжу, а з неї в кров до власних білків організму людини відбувається в печінці. Профілактика і лікування харчової алергії полягає у виключенні нестерпних продуктів харчування з добового раціону.
15. Вроджена порушення амінокислотного обміну у людини.
Фенілкетонурія. В основі цього порушення лежить мутація гена що кодує фермен, який бере участь в перетвореннях фенілаланіну. У здорової людини під дією кисню повітря фенілаланін перетворюється в тирозин.
Фенілаланін + НАДН + Про тирозин + НАД + Н Про
При спадковому діффеціте перетворення йде іншим шляхом з утворенням фенілпірувата. Надлишок фенілпірувата в крові у новонароджених порушує нормальний розвиток мозку і є причиною розумової відсталості. При досить ранньому виявленні можна створити умови для нормального розвитку дитини шляхом виключення фенілаланін містять продуктів.
Реакція освіти фенілпірувата: