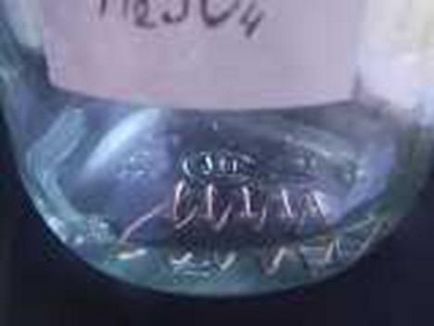Мідь. Хімічний елемент, символ Cu (лат. Cuprum, від лат. Назви острова Кіпр, звідки греки і римляни вивозили мідь), має порядковий номер 29, атомна вага 63, 54, основну валентність II, щільність 8, 9 г / см 3. температуру плавлення 1083 ° С, температуру кипіння 2600 ° С.
Її знали в давнину раніше заліза і вживали, особливо в сплаві з іншими металами, для зброї та домашніх предметів.
Мідь, єдиний метал, який має червонуватий колір. Це відрізняє її від всіх інших металів.
У хімічному відношенні мідь є малоактивним металом. Чистий прісна вода і сухе повітря практично не викликають корозії міді, але на повітрі, в присутності вуглекислого газу, вона покривається плівкою зеленого кольору (патиною), гідроокісним карбонатом міді CuCO 3. Cu (OH) 2. При нагріванні на поверхні металу утворюється чорний наліт окису міді CuO.
Незначний вплив на хімічну стійкість міді надають сухі гази, ряд органічних кислот, спирти і фенольні смоли, до вуглецю мідь пасивна. Гарну корозійну стійкість володіє мідь і в морській воді. При відсутності інших окислювачів на мідь не діють розбавлені сірчана і соляна кислоти. Однак у присутності кисню повітря мідь розчиняється в цих кислотах з утворенням відповідних солей (в сірчаної кислоти. Утворюючи сульфат CuSO 4; в соляній кислоті. Утворюючи хлорид міді CuCl 2), в азотній кислоті мідь розчиняється, утворюючи нітрат Cu (NO 3) 2.
При взаємодії її з оцтовою кислотою утворюється основний ацетат міді - отруйна ярь-мідянка.
За реакцією в азотній кислоті можна перевіряти сплави на наявність міді - якщо кислота придбала синьо-зелений колір, значить, в сплаві присутній мідь.
Мідь погано чинить опір дії аміаку, аміачних солей і лужних ціаністих з'єднань. Корозію міді викликають також хлористий амоній і окисні мінеральні кислоти.
На фотографіях показані початку реакцій при кімнатній температурі.
Мідь має гарний блиск і високою полірованого, проте блиск її досить швидко зникає.
Вона отримала широке застосування в техніці і промисловості завдяки ряду цінних властивостей, якими володіє. Найважливішими властивостями міді є високі електро- і теплопровідність, висока пластичність і здатність піддаватися пластичної деформації в холодному і нагрітому станах, хороша опірність корозії і здатність до утворення багатьох сплавів з широким діапазоном різних властивостей. За показниками електро- і теплопровідності мідь поступається тільки сріблу. має дуже високу питому теплоємність. Мідь діамагнітна.
Більше 50% видобутої міді застосовується в електротехнічній промисловості (чиста мідь); приблизно 30-40% міді застосовується у вигляді сплавів, які мають велике значення (латуні, бронзи, мельхіору та ін.). Наприклад, у виробництві напівпровідникових приладів мідь використовують для виготовлення деталей самого приладу, перш за все висновків і крісталлодержателя (крісталлодержателя - це деталь, на якій безпосередньо укріплена пластинка напівпровідника) потужних приладів і деталей технологічного обладнання.
Хороша теплопровідність міді, її висока корозійна стійкість дозволяють використовувати цей метал для виготовлення різних теплообмінників, трубопроводів і т.п. наприклад, тази з міді забезпечують рівномірний нагрів при варінні варення.
Найважливіші солі міді:
- сульфат міді CuSO 4 в безводному стані являє собою білий порошок, який при поглинанні води синіє, і, отже, водний розчин сульфату набуває синьо-блакитний колір. З водних розчинів сульфат міді кристалізується з п'ятьма молекулами води, утворюючи прозорі сині кристали. У такому вигляді він називається мідним купоросом;
- хлорид міді CuCl 2. 2H 2 O утворює темно-зелені кристали, легко розчинні у воді;
- нітрат міді Cu (NO 3) 2. 3H 2 O виходить при розчиненні міді в азотній кислоті. При нагріванні кристали міді спочатку втрачають воду, а потім розкладаються з виділенням кисню та бурого діоксиду азоту, переходячи в оксид міді;
- ацетат міді Cu (CH 3 COOO) 2. H 2 O виходить при обробці міді або її оксиду оцтовою кислотою. Під назвою ярь-мідянка застосовується для приготування олійної фарби;
- змішаний ацетат-арсеніт міді Cu (CH 3 COO) 2. Cu 3 (AsO 3) 2 застосовується під назвою паризька зелень для знищення шкідників рослин.
З солей міді виробляють велику кількість мінеральних фарб, різних за кольором: зелених, синіх, коричневих, фіолетових, чорних.
Всі солі міді отруйні, тому мідний посуд лудять (покривають шаром олова), щоб запобігти можливості утворення мідних солей.
Мідь належить до числа життєво важливих мікроелементів. Таку назву отримали Fe, Cu, Mn, Mo, B, Zn, Co в зв'язку з тим, малі кількості їх необхідні для нормальної життєдіяльності рослин. Мікроелементи підвищують активність ферментів, сприяють синтезу цукру, крохмалю, білків, нуклеїнових кислот, вітамінів і ферментів. Найчастіше мідь вносять в грунт у вигляді мідного купоросу. У значних кількостях він отруйний, як і багато інших з'єднань міді, а в малих же дозах мідь необхідна всьому живому.
У технічній міді в якості домішок містяться: вісмут, сурма, миш'як, залізо, нікель. свинець. олово. сірка, кисень, цинк та інші. Всі домішки, що знаходяться в міді, знижують її електропровідність. Температура плавлення, щільність, пластичність і інші властивості міді також значно змінюються від присутності в ній домішок.
Вісмут і свинець в сплавах з міддю утворюють легкоплавкіевтектики (від грецького eutektos - сплав, точка плавлення якого нижче точок плавлення входять до його складу компонентів, якщо останні не утворюють між собою хімічної сполуки), які при кристалізації тверднуть в останню чергу і розташовуються по межах раніше випали зерен міді (кристалів). При нагріванні до температур, що перевищують точки плавлення евтектики (270 і 327 ° С відповідно), зерна міді роз'єднуються рідкої евтектики. Такий сплав є красноломкость і при прокатці в гарячому стані руйнується. Червоноламкість міді може викликатися присутністю в ній тисячних часток відсотка вісмуту і сотої частки відсотка свинцю. При підвищеному вмісті вісмуту і свинцю мідь стає крихкою і в холодному стані.
Сірка і кисень утворюють з міддю тугоплавкі евтектики з точками плавлення вище температур гарячої обробки міді (1065 і 1 067 ° С). Тому присутність в міді невеликих кількостей сірки і кисню не супроводжується появою красноломкості. Однак значне підвищення вмісту кисню призводить до помітного зниження механічних, технологічних і корозійних властивостей міді; мідь стає красноломкость і хладноломкость.
Мідь, що містить кисень, при відпалі її у водні або в атмосфері, що містить водень, робиться крихкою і розтріскується. Це явище відоме під назвою «водневої хвороби». Розтріскування міді в цьому випадку відбувається в результаті утворення значної кількості водяної пари при взаємодії водню з киснем міді. Водяна пара при підвищених температурах мають високий тиск і руйнують мідь. Наявність тріщин в міді встановлюється шляхом випробування на вигин і кручення, а також мікроскопічним методом. У міді, ураженої водневої хворобою, після полірування добре видно характерні темні включення пір і тріщин.
Сірка знижує пластичність міді при холодній і гарячій обробці тиском і покращує оброблюваність різанням.
Залізо розчиняється в міді в твердому стані досить незначно. Під впливом домішок заліза різко знижуються електро- і теплопровідність міді, а також її корозійна стійкість. Структура міді під впливом домішок заліза подрібнюється, що підвищує її міцність і зменшує пластичність. Під впливом заліза мідь стає магнітної.
Берилій є розкислювачем по відношенню до міді, кілька знижує електропровідність її, підвищує механічні властивості і значно зменшує окислення при підвищених температурах.
Фосфор сильно знижує електро- і теплопровідність міді, але позитивно впливає на її механічні властивості і вологотекучість. Фосфор широко застосовується в ливарній справі в якості раскислителя міді і робить позитивний вплив при зварюванні міді.
Алюміній підвищує корозійну стійкість і знижує окислюваність міді при нормальній і підвищеній температурах, значно знижує її електро- і теплопровідність, а також чинить негативний вплив при пайку і лудінні мідних виробів. На механічні властивості і оброблюваність міді тиском домішка алюмінію не робить помітного впливу. Розчинність алюмінію в міді в твердому стані становить 9,6%.