У завданнях, пов'язаних з додаванням до розчину певної кількості розчинника або розчиненого речовини, необхідно спочатку розрахувати масу розчиненої речовини в вихідному розчині, а потім використовувати її для подальших обчислень. Умова кожного завдання для більшої наочності краще зобразити у вигляді малюнка.
Завдання 1.
До 180,0 г 8% -ного розчину хлориду натрію додали 20 г NaС1. Масова частка хлориду натрію в нинішньому розчині дорівнює. % (Запишіть число з точністю до десятих).
дано:
маса вихідного розчину: mісх.р-ра = 180 г;
масова частка NaС1 в вихідному розчині: (NaС1) в вих розчині = 8%;
маса доданої солі NaС1: m (NaСl) добавл = 20 м
знайти:
масову частку солі в кінцевому розчині: (NaС1) в кін / р-ре
Рішення:
Умова завдання зручно відобразити у вигляді малюнка:
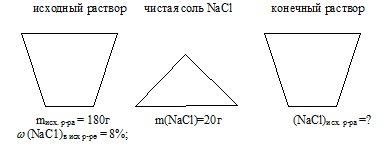
1. Знаходимо масу NaСl в вихідному розчині:
2. Маса NaС1 в кінцевому розчині являє собою суму:
m (NаС1) в кон.р.ре = m (NаС1) в вих. р.ре + m (NаС1) добавл. = 14,4+ 20 = 34,4 м
3. Масу доданої солі враховуємо і в масі кінцевого розчину:
mкон. р-ра = mісх. р-ра + m (NаС1) добавл. = 180 + 20 = 200 м
4. Отримані дані дозволяють визначити масову частку в кінцевому розчині:
Завдання, в якій додається певна кількість води до порції розчину відомої концентрації, вирішується за тим же алгоритмом.
У задачі на змішання двох розчинів потрібно проводити трохи більшу кількість розрахунків. В цьому випадку необхідно обчислити масу розчиненої речовини в кожному з
вихідних розчинів.
Завдання 2.
Змішали 200 г 20% -ного розчину NаОН з 218 мл 10% -ного розчину того ж речовини (p = 1,11 г / мл). Масова частка лугу в отриманому розчині. % (Запишіть число з точністю до десятих).
дано:
маса першого розчину NаОН: m1 вих р-ра = 200 г;
масова частка NаОН в першому розчині: з (Маон) в 1 вих р-ре = 20%;
обсяг другого розчину NаОН: V2ісх.р-ра = 218 мл;
масова частка NаОН в другому розчині: (NаОН) у 2 вих. розчині = 10%;
щільність другого вихідного розчину: р2 вих. р.р = 1,11 г / мл.
Знайти: масову частку NаОН в кінцевому розчині: (NаОН) в кін розчині
Рішення:
Умова завдання зручно відобразити у вигляді малюнка:
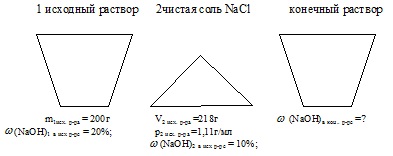
При вирішенні даного завдання необхідно визначити масу NаОН в кожному з вихідних розчинів. Далі знайти сумарну масу кінцевого розчину і масу NаОН в ньому. Після цього обчислюємо шукану величину.
Схематично алгоритм рішення можна відобразити так:
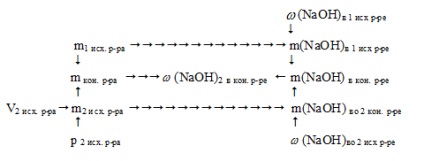
1. Знаходимо масу NаОН в першому вихідному розчині:
2. Знаходимо масу другого вихідного розчину:
m2 вих. р-ра = V2 вих. р-ра. p 2 вих. р-ра = 218. 1,11 = 242 м
3. Знаходимо масу NаОН в другому вихідному розчині:
m (NaOH) в кін. розчині = m (NaOH) в 1 вих. розчині + m (NaOH) у 2 вих. розчині = 40 + 24,2 = 64,2 м
5. Знаходимо масу кінцевого розчину:
mкон. р-ра = m1 вих. р-р а + m2 вих. р-ра = 200 + 242 = 442 м
6. Знаходимо масову частку NаОН в кінцевому розчині:
Округляем отримане значення до десятих.
Відповідь: (NaOH) в кон.р-ре = 14,5%.
У задачі на випарювання маса розчину зменшується зазвичай за рахунок видалення розчинника. При цьому маса розчиненої речовини залишається незмінною, що призводить до збільшення концентрації.
Завдання 3.
Визначте масу води, яку необхідно випарувати з 2 л 10% розчину NаОН (р = 1,11 г / мл) для підвищення масової частки NаОН в ньому до 15%. Відповідь. г (запишіть число з точністю до цілих).
дано:
обсяг вихідного розчину: Vісх. р-ра = 2 л;
щільність вихідного розчину: рісх розчину = 1,11 г / мл;
масова частка NаОН в вихідному розчині: (NаОН) в вих р.ре = 10%;
масова частка NаОН в кінцевому розчині: (NаОН) в кін розчині = 15%
Знайти: масу води, що випарувалася: m (Н2 О) випарувався =?
Рішення:
При випаровуванні водного розчину NаОН випаровуватися буде тільки вода. Маса NаОН буде однаковою як у вихідному, так і в кінцевому розчині.
Схематично алгоритм рішення можна представити таким чином:
1. Знайдемо масу вихідного розчину:
2. Знайдемо масу NаОН в вихідному розчині:
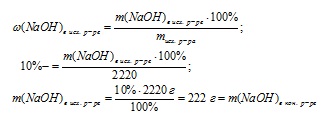
3. Визначимо масу кінцевого розчину:
4. Зменшення маси розчину відбулося тільки через випаровування води, отже, за різницею мас вихідного і кінцевого розчинів можна знайти масу випарується води:
m (Н2 О) випарувалося = mісх розчину - mкон. р-ра = 2220 - 1480 = 740 м
Відповідь: m (Н2 О) випарувалося = 740 м
В умовах деяких завдань передбачається виведення з розчину у вигляді газу легколетучего розчиненої речовини (наприклад МН3; НС1; Н2 S або розчиненого у воді органічної речовини). Для вирішення таких завдань необхідно вважати незмінною масу розчинника (води).
Завдання 4.
При нагріванні 200 г 25% -ного розчину аміаку 20 г цієї речовини зникло. Масова частка аміаку в розчині після нагрівання дорівнює. % (Запишіть число з точністю до десятих).
дано:
маса вихідного розчину: mісх розчину = 200 г;
масова частка NН3 у вихідному розчині: (NН3) в вих. розчині = 25%;
маса випарувалися аміаку: m (NН3) зникло = 20 м
Знайти: масову частку NH3 в кінцевому розчині: (NН3) в кін. р ре =?
Рішення:
Схематично алгоритм рішення можна представити таким чином:
1. Знаходимо масу NН3 у вихідному розчині:
2. Знаходимо масу NН3 в кінцевому розчині:
Знаходимо масу кінцевого розчину 1:
4. Знаходимо масову частку аміаку в кінцевому розчині:
Округляем значення, згідно з вимогою умови, і отримуємо: (NН3) в кін. розчині = 16,7%.
Відповідь: (NН3) в кін. розчині = 16,7%.
- Ви тут:
- Головна
- завдання
- ЄДІ-хімія
- Визначення масової і мольной частки кожної солі в суміші | Завдання 33 - 34