МЕТОДИ мікроскопірованіі гістологічних препаратів
МЕТОДИ мікроскопірованіі гістологічних препаратів
Основним методом вивчення біологічних мікрооб'єктів є світлова та електронна мікроскопія, які широко використовуються в експериментальній і клінічній практиці.
Світлова мікроскопія. Для вивчення гістологічних мікрооб'єктів застосовують звичайні світлові мікроскопи і їх різновиди, в яких використовуються джерела світла з хвилями різної довжини. У звичайних світлових мікроскопах джерелом освітлення служить природний або штучний світло (рис. 2.1). Мінімальна довжина хвилі видимої частини спектра приблизно 0,4 мкм. Отже, для звичайного світлового мікроскопа найменше разрешаемое відстань приблизно становить 0,2 мкм, а загальне збільшення (твір збільшення об'єктива на збільшення окуляра) може бути 1500-2500.
Таким чином, за допомогою світлового мікроскопа можна побачити не тільки окремі клітини розміром від 4 до 150 мкм, а й їх внутрішньоклітинні структури - органели, включення. Для посилення контрастності мікрооб'єктів застосовують їх фарбування.
Ультрафіолетова мікроскопія. Це різновид світлової мікроскопії. В ультрафіолетовому мікроскопі використовують більш короткі ультрафіолетові промені з довжиною хвилі близько 0,2 мкм. Разрешаемое відстань тут в 2 рази менше, ніж в звичайних світлових мікроскопах, і становить приблизно 0,1 мкм. Отримане в ультрафіолетових променях невидиме оком зображення перетвориться у видиме за допомогою реєстрації на фотопластинці або шляхом застосування спеціальних пристроїв (люмінесцентний екран, електронно-оптичний перетворювач).
Флюоресцентная (люмінесцентна) мікроскопія. Явища флюоресценції полягають в тому, що атоми і молекули ряду речовин, поглинаючи коротко-
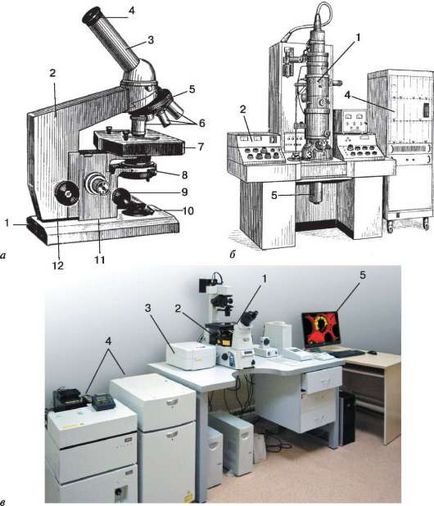
Мал. 2.1. Мікроскопи для біологічних досліджень:
3 - скануючий пристрій для переміщення світлового променя по осі X, Y, Z;
4 - блок живлення і стійка управління лазерами; 5 - комп'ютер для обробки зображень
хвильові промені, переходять в збуджений стан. Зворотний перехід із збудженого стану в нормальне відбувається з випусканням світла, але з більшою довжиною хвилі. У флюоресцентної мікроскопі в якості джерел світла для збудження флюоресценції застосовують ртутні або ксе-ноновие лампи надвисокого тиску, що володіють високою яскравістю в області спектра 0,25-0,4 мкм (ближні ультрафіолетові промені) і 0,4-0,5 мкм (синьо фіолетовий промені). Довжина світлової хвилі флюоресценції завжди більше довжини хвилі збуджуючого світла, тому їх поділяють за допомогою світлофільтрів і вивчають зображення об'єкта тільки в світлі флюоресценції. Розрізняють власну, або первинну, і наведену, або вторинну, флюоресценцію. Будь-яка клітина живого організму володіє власною флюоресценцией, проте вона часто буває надзвичайно слабкою.
Первинною флюоресценцией мають серотонін, катехоламіни (адреналін, норадреналін), що містяться в нервових, здорових та інших клітинах, після фіксації тканин в парах формальдегіду при 60-80 ° С (метод Фалька).
Вторинна флюоресценція виникає при обробці препаратів спеціальними барвниками - флюорохромами.
Існують різні флюорохромами, які специфічно зв'язуються з певними макромолекулами (акридіновий помаранчевий, родамін, флюоресцеин і ін.). Наприклад, при обробці препаратів акридиновим помаранчевим ДНК і її сполуки в клітинах мають яскраво-зелене, а РНК і її похідні - яскраво-червоне свічення. Існує багато барвників, за допомогою яких можна виявити білки, ліпіди, внутрішньоклітинні іони кальцію, магнію, натрію та ін. Таким чином, спектральний склад випромінювання несе інформацію про внутрішню будову об'єкта і його хімічний склад. Варіант методу флюоресцентної мікроскопії, при якому і збудження, і випромінювання флуоресценції відбуваються в ультрафіолетовій області спектра, отримав назву методу ультрафіолетової флюоресцентной мікроскопії.
Для підвищення контрастності флюорохромірованних об'єктів застосовується конфокальний варіант оптичного мікроскопа (див. Рис. 2.1, в). В якості освітлення використовується пучок монохроматичного світла малого діаметра, який створює лазерний джерело. У кожен момент часу в фокусі мікроскопа знаходиться невелика ділянка (обсяг) клітини. Пучок світла переміщається по об'єкту (сканує об'єкт по осях X, Y, Z). При кожному переміщенні пучка світла по одній з ліній сканування виходить інформація про досліджувану структурі, що знаходиться в даній точці (обсязі) по лінії сканування (оптичному зрізі клітини), наприклад про локалізацію білків в складі микротрубочек в клітці. Вся отримана інформація від кожної точки сканування клітини передається на комп'ютер, об'єднується за допомогою спеціальної програми і видається на екран монітора у вигляді контрастного зображення. За допомогою даного методу мікроскопії виходить інформація про форму клітин, цітоскеле-ті, структурі ядра, хромосом і ін. За допомогою програми комп'ютер на основі отриманої інформації по кожній лінії сканування створює об'ємне зображення клітини, що дозволяє розглядати клітку під різними кутами зору.
Фазовоконтрастна мікроскопія. Цей метод служить для отримання контрастних зображень прозорих і безбарвних живих об'єктів, невидимих при звичайних методах микроскопирования. Метод заснований на тому, що світло, проходячи структури з різним коефіцієнтом заломлення, змінює свою швидкість. Використовувана конструкція оптики мікроскопа дає можливість перетворити які не сприймаються оком фазові зміни пройшов через незабарвлений препарат світла в зміни його амплітуди, т. Е. Яскравості одержуваного зображення. Метод фазового контрасту забезпечує контрастність досліджуваних нефарбованих структур за рахунок спеціальної кільцевої діафрагми, що поміщається в конденсорі, і так званої фазової пластинки, що знаходиться в об'єктиві. Різновидом методу фазового контрасту є метод фазово-темнопольного контрасту, що дає негативний порівняно з позитивним фазовим контрастом зображення.
Мікроскопія в темному полі. У темнопольному мікроскопі тільки світло, який дає дифракцию (огибание хвилями) структур в препараті, досягає об'єктива. Відбувається це завдяки наявності в мікроскопі спеціального конденсора, який висвітлює препарат строго косим світлом; промені від освітлювача направляються збоку. Таким чином, поле виглядає темним, а дрібні частинки в препараті відбивають світло, який далі потрапляє в об'єктив. У клініці цей метод застосовують для вивчення кристалів в сечі (сечова кислота, оксалати), для демонстрації спирохет, зокрема Treponema pallidum, що викликає сифіліс, і ін.
Інтерференційна мікроскопія. Різновидами фазово-контрастного мікроскопа є інтерференційний мікроскоп, який призначений для кількісного визначення маси тканини. Диференціальний інтерференційний мікроскоп (з оптикою Номарського) використовують для вивчення рельєфу поверхні клітин та інших біологічних об'єктів.
У інтерференційному мікроскопі пучок світла від освітлювача розділяється на два потоки: один проходить через об'єкт і змінюється по фазі коливання, другий йде, минаючи об'єкт. У призмах об'єктива обидва пучка накладаються один на одного. В результаті будується зображення, в якому ділянки мікрооб'єкту різної товщини і щільності розрізняються за ступенем контрастності. Провівши кількісну оцінку змін, визначають концентрацію і масу сухого речовини.
Поляризаційна мікроскопія. Поляризаційний мікроскоп є модифікацією світлового мікроскопа, в якому встановлені два поляризаційних фільтра: перший (поляризатор) - між пучком світла і об'єктом, а другий (аналізатор) - між лінзою об'єктива і оком. Через перший фільтр світло проходить тільки в одному напрямку, другий фільтр має головну вісь,
яка розташовується перпендикулярно першому фільтру, і він не пропускає світло. Виходить ефект темного поля. Структури, які містять поздовжньо орієнтовані молекули (колаген, мікротрубочки, мікрофіламенти), і кристалічні структури, мають властивість обертати вісь світлових променів, що виходять з поляризатора. При зміні осі обертання дані структури проявляються як світяться на темному тлі. Здатність кристалів або паракрісталліческіх утворень до роздвоєння світлової хвилі на звичайну і перпендикулярну до неї називається подвійне променезаломлення. Таку здатність мають фібрили поперечносмугастих м'язів.
Електронна мікроскопія. Великим кроком вперед у розвитку техніки мікроскопії було створення і застосування електронного мікроскопа (див. Рис. 2.1). В електронному мікроскопі використовується потік електронів з хвилями коротшими, ніж в світловому мікроскопі. При напрузі 50 000 В довжина хвилі електромагнітних коливань, що виникають при русі потоку електронів у вакуумі, дорівнює 0,0056 нм. Теоретично розраховано, що разрешаемое відстань в цих умовах може бути близько 0,002 нм, або 0,000002 мкм, т. Е. В 100 000 разів менше, ніж в світловому мікроскопі. Практично в сучасних електронних мікроскопах разрешаемое відстань складає близько 0,1-0,7 нм.
У гістології використовуються трансмісійні (просвічують) електронні мікроскопи (ТЕМ), скануючі (растрові) електронні мікроскопи (СЕМ) та їх модифікації. За допомогою ТЕМ можна отримати лише площинне зображення досліджуваного мікрооб'єкту. Для отримання просторового уявлення про структури застосовують СЕМ, здатні створювати тривимірне зображення. Растровий електронний мікроскоп працює за принципом сканування електронним микрозондом досліджуваного об'єкта, т. Е. Послідовно «обмацує» гостро сфокусованим електронним пучком окремі точки поверхні. Таке дослідження об'єкта називається скануванням (зчитуванням), а малюнок, по якому рухається микрозонд, - растром. Отримане зображення виводиться на телевізійний екран, електронний промінь якого рухається синхронно з микрозондом.
Головними перевагами растрової електронної мікроскопії є велика глибина різкості, широкий діапазон безперервного зміни збільшення (від десятків до десятків тисяч разів) і висока роздільна здатність. Сучасними варіантами приладів для вивчення поверхні об'єкта є атомно-силовий мікроскоп і тунельний мікроскоп.
Електронна мікроскопія з використанням методу заморожування - сколювання застосовується для вивчення деталей будови мембран і міжклітинних з'єднань. Для виготовлення відколів клітини заморожують при низькій температурі (-160 ° С). При дослідженні мембрани площину відколу проходить через середину бислоя ліпідів. Далі на внутрішні поверхні отриманих половинок мембран напилюють метали (платина, паладій, уран), вивчають їх за допомогою ТЕМ і мікрофотографії.
Метод Кріоелектронний мікроскопії. Швидко заморожений тонкий шар (близько 100 нм) зразка тканини поміщають на мікроскопічну грати і досліджують в вакуумі мікроскопа при -160 ° С.
Метод електронної мікроскопії «заморожування - травлення» застосовують для вивчення зовнішньої поверхні мембран клітин. Після швидкого заморожування клітин при дуже низькій температурі блок розколюють лезом ножа. Утворені кристали льоду видаляють шляхом сублімації води в вакуумі. Потім ділянки клітин відтіняють, напиляя тонку плівку важкого металу (наприклад, платини). Метод дозволяє виявляти тривимірну організацію структур.
Таким чином, методи заморожування - сколювання і заморожування - травлення дозволяють вивчати нефіксовані клітини без освіти в них артефактів, що викликаються фіксацією.
Методи контрастування солями важких металів дозволяють досліджувати в електронному мікроскопі окремі макромолекули - ДНК, великих білків (наприклад, міозин). При негативному контрастировании вивчають агрегати макромолекул (рибосоми, віруси) або білкові філаменти (Актинові нитки).
Електронна мікроскопія ультратонких зрізів, отриманих методом кріоультрамікро-томии. При цьому методі шматочки тканин без фіксації і заливки в тверді середовища швидко охолоджують в рідкому азоті при температурі -196 ° С. Це забезпечує гальмування метаболічних процесів клітин і перехід води з рідкої фази в тверду. Далі блоки ріжуть на ультрамікротоме при низькій температурі. Такий метод приготування зрізів зазвичай використовують для визначення активності ферментів, а також для проведення иммунохимических реакцій. Для виявлення антигенів застосовують антитіла, пов'язані з частками колоїдного золота, локалізацію якого легко виявити на препаратах.
Методи сверхвисоковольтной мікроскопії. Використовують електронні мікроскопи з прискорює напругою до 3 000 000 В. Перевага цих мікроскопів в тому, що вони дозволяють досліджувати об'єкти великої товщини (1-10 мкм), так як при високій енергії електронів вони менше поглинаються об'єктом. Стереоскопічний зйомка дозволяє отримувати інформацію про тривимірної організації внутрішньоклітинних структур з високою роздільною здатністю (близько 0,5 нм).