Іншим важливим прикладом відхилення від рівноваги є утворення в процесі фазових перетворень метастабільних фаз. Так називають нерівноважні фази, що представляють собою в одних випадках:
а) перехідну стадію між вихідної фазою і рівноважної,
б) фазу, стійку при певних співвідношеннях тиску, температури і концентрацій.
На діаграмах фазових равновесійметастабільние рівноваги зображуються штриховими лініями.
Метастабільні фази утворюються при кристалізації елементарних речовин і подвійних сплавів при значному переохолодженні розплавів (розчинів), при цьому температурно-концентраційна область, в якій ці фази є метастабільними, має різну протяжність. Ізобарно-ізотермний потенціал у метастабільною фази менше, ніж у вихідної, але більше, ніж у рівноважної фази, тому перетворення метастабільною фази в рівноважну вимагає певної енергії активації, при відсутності якої метастабільна фаза може існувати як завгодно довго.
Освіта метастабільних фаз - явище, часто спостерігається і широко використовується і при перетвореннях в твердому стані. Так само як, перш за все, освіту пересичених твердих розчинів, якщо їх розпад здійснюється при низьких температурах, коли дифузія і відповідно утворення рівноважних фаз утруднені.
Є всі підстави припускати, що спостерігається в сильно легованих напівпровідниках розбіжність концентрації електрично активної домішки і її загальної (хімічної) концентрації (політропи домішки) є в ряді випадків результатом початкових стадій розпаду твердого розчину, в процесі якого за участю домішки утворюються метастабільні фази.
Для опису метастабільних фаз використовують спеціальні діаграми фазових рівноваг метастабільних фаз - так звані метастабільні діаграми. Області метастабильности і метастабільні хімічні сполуки на таких діаграмах показують штрихованої лінією. Питання про застосування правила фаз до метастабільним діаграм є дискусійним. На рис. 9.3 наведені діаграми фазового рівноваги систем З-С і Ni-С і метастабільні діаграми цих систем.
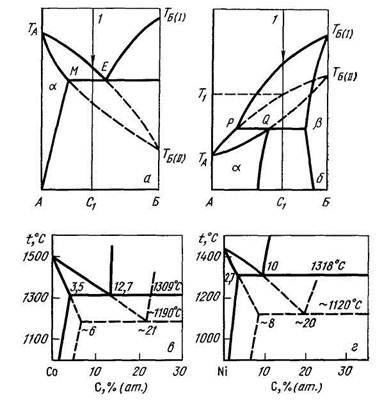
Мал. 9.3. Метастабільні діаграми (суцільні лінії - стабільне, штриховані - метастабильное рівноваги): а - можливі метастабільні рівноваги в діаграмі евтектичного типу; б - можливі метастабільні рівноваги в діаграмі перитектического типу; в - метастабільна діаграма системи Со-С; г - метастабільна діаграма системи Ni-C.
Величина метастабильности визначається різницею між енергіями метастабільною фази і суміші стабільних фаз. При дуже великих швидкостях охолодження (10 2 - 10 10) К / с з переохолоджених розплавів (розчинів) нижче певної температури можна отримати тверді метастабільні фази не тільки в кристалічному, а й в аморфному стані (коли в фазі є ближній порядок і відсутній дальній порядок в розташуванні атомів). Сплави в аморфному стані можна отримувати не тільки при кристалізації з рідкої фази, але і при осадженні з газової фази. Для отримання в аморфному стані фаз з ковалентним типом зв'язку потрібні менші швидкості охолодження, по порівняння з фазами з металевим типом зв'язку.
Знати діаграму фазових рівноваг необхідно також при виборі складів рідкої фази і температурних умов кристалізації. Це особливо важливо при отриманні кристалів сполук. Розглянемо це на прикладі отримання монокристалів витягуванням їх з рідкої фази по методу Чохральського.
Кристалізація відбувається на кристалі-затравки, дотичної з поверхнею рідкого розплаву, переохолодженого на # 8710; T нижче температури ліквідусу. Це переохолодження підтримується протягом усього процесу кристалізації. У міру кристалізації нових шарів твердої фази на затравки кристал витягають з рідкої фази. Склад кристалізується твердої фази визначається діаграмою фазової рівноваги, якщо в процесі витягування підтримуються умови, близькі до рівноважних (швидкість кристалізації мала, широко розвинені процеси дифузії в твердій і рідкій фазі, тобто # 8710; Т → 0).
Конгруентно плавляться з'єднання, наприклад GaTe і Ga2 Te3 (див. Рис. 8.2 а. Л. 8), можна отримувати з рідкої фази того ж складу, що і склад з'єднання. Їх можна отримувати і кристалізацією з розплаву кілька відрізняється складу: наприклад, з'єднання GaTe - з розплаву складу Х1 кристалізацією при будь-якої з температур в інтервалі між 1100 і 1019 К. Однак при цьому слід враховувати, що якщо з'єднання має певну областю гомогенності, то витягати кристал не матиме стехіометричного складу, а буде являти собою твердий розчин граничної концентрації на основі цього з'єднання, рівноважний для температури кристалізації.
Інконгруентно плавляться з'єднання не можна отримувати з рідкої фази того ж складу. Так, на рис. 8.2, л. 8 видно, що з рідкої фази, що відповідає складу GaTe3 при переохолодженні нижче лінії ліквідусу, буде кристалізуватися тверда фаза складу Ga2 Te3. а не GaTe3. Щоб при кристалізації з рідкої фази виділялося конгруентно плавиться з'єднання GaTe3. склад рідкої фази повинен лежати в інтервалі концентрації від Х2 до Х3. а кристалізацію слід вести при температурі в інтервалі між Т3 (
760 К) і Т4 (709 К). Розглянуту вище кристалізацію інконгруентно плавиться з'єднання прийнято називати кристалізацією з розчину.