Механізм дії ферментів
При ферментативному каталізі проявляються білкова природа ферментів, їх термолабильность, вплив рН середовища, специфічність дії, висока каталітична здатність, чутливість до активаторам і інгібіторів. Ферментативна реакція протікає відповідно до закону дії мас.
Ферменти і енергія активації. Ферменти - це біологічні каталізатори. Вони впливають на швидкість реакцій в двох напрямках: прискорюють розщеплення або синтез певних речовин. Збільшення швидкості реакції відбувається внаслідок зміни енергії активації молекул субстратів. Енергія активації E характеризує енергетичний бар'єр, який необхідно подолати, щоб привести реагують речовини в активний стан. Він обумовлений силами міжмолекулярної зчеплення або міжмолекулярної відштовхування реагуючих речовин. Швидкість реакції можна збільшити, якщо збільшити число активуються молекул або зменшити висоту енергетичного бар'єру.
Молекули субстратів можна привести в активний стан різними прийомами. Одним з них є нагрівання, при якому в розчинах зростають швидкість руху молекул і вони не торкались одна. При наявності каталізатора знижуються енергетичний бар'єр і енергія активації (колір. Табл. IV). Так, для розщеплення сахарози на глюкозу і фруктозу під впливом сірчаної кислоти E = 134 400 Дж / моль, а за участю інвертази - 40 420 Дж / моль. Для гідролізу казеїну соляної
кислотою E = 109 200 Дж / моль, пепсином - 50 400 Дж / моль. Енергія активації розкладання пероксиду водню (рис. 40) без каталізатора дорівнює 75 600 Дж / моль (E1), за участю колоїдної платини - 49 140 (E2), каталази печінки - 23 100 Дж / моль (E3).
Теорія ферментативного каталізу. Процеси каталізу найбільш повно пояснює теорія Міхаеліса - Ментена. Відповідно до цієї теорії є чотири етапи.
I етап. Між субстратом (S) і ферментом (E), виникає зв'язок - утворюється фермент-субстратної комплекс ES, в якому компоненти пов'язані між собою ковалентним, іонним, водневої і іншими зв'язками.
II етап. Субстрат під впливом приєднаного ферменту активується, стаючи доступним для відповідних реакцій каталізу ES.
III етап. Здійснюється каталіз ES *.
IV етап. Звільняються молекула ферменту E і продукти реакції P.
Послідовність перетворень відображає наступна схема:
Теорія ферментативного каталізу підтверджена експериментально. Так, з хрону виділений фермент, який розщеплює пероксид водню - пероксидаза коричневого кольору. Після з'єднання ферменту E з субстратом H2 O2 (S) виникає фермент-субстратної комплекс ES зеленого кольору. Через деякий час субстрат активується, утворюючи фермент-активоване субстрат ES * червонуватого кольору. Він розщеплюється на коричневий фермент E і продукти розпаду P.
Активний центр ферменту. частинки ферменту
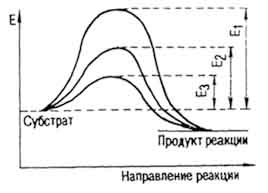
Мал. 40. Зниження енергії активації за допомогою каталізатора (по Е. Гофманом)
володіють великим запасом вільної енергії і можуть адсорбувати на поверхні молекули або частини молекул субстратів, розміри яких в більшості випадків у багато разів менше, ніж розміри молекули ферменту. При взаємодії ферменту і субстрату змінюється конфігурація його частки - виникають своєрідні поглиблення, в яких і утворюється фермент-субстратної комплекс. Цю частину молекули ферменту прийнято називати субстратсвязивающім ділянкою. У молекулі ферменту виділяється ділянка, що здійснює каталіз, - активний центр. Частина молекули ферменту, яка пов'язує низькомолекулярні метаболіти або ефектори, які змінюють її третинну структуру і інгібуючі активність ферменту, називають аллостерическим центром. Більшість ферментів має один, деякі - два і більше активних центрів. Субстратсвязивающій і активний центри часто територіально збігаються. Молекули трипсину і карбоксипептидази мають по одному активному центру, гліцеральдегідфосфатдегідрогенази - 2, уреази - 3-4, холінестерази - 20-100.
Активний центр містить угруповання, які здійснюють тісну взаємодію між частинками субстрату і ферменту. Вони здатні знижувати енергію активації, утворюючи спочатку комплекс ES, потім ES * і, нарешті, E і P. У простих ферментів в освіті активного центру беруть участь білкові функціональні групи, у складних ферментів - і відповідні кофактор. Амінокислотні залишки, що входять в активний центр, можна розділити на три види. Частина з них несе групи, що діють на субстрат в процесі каталізу, інші здійснюють контакт між ферментом і субстратом, треті виконують чисто структурну роль в підтримці третинної структури молекули ферменту. В ході каталітичного акту відбувається своєрідна индуцированная "підгонка" субстрату (іноді і інгібітору) до активного центру (рис. 41).
Хімізм взаємодії активного центру з субстратом найбільш докладно вивчено для ацетилхолінестерази (АХЕ). Вона відноситься до простих ферментам. Активний центр його молекули (рис. 42, А) містить не менше чотирьох залишків амінокислот: серина, гістидину, тирозину і глутамінової кислоти. На I етапі
Мал. 41. Схема індукованої "підгонки" ферменту і субстрату, ферменту і інгібітору) по Д. Б. Моссу, Л. Дж. Ваттерворту)
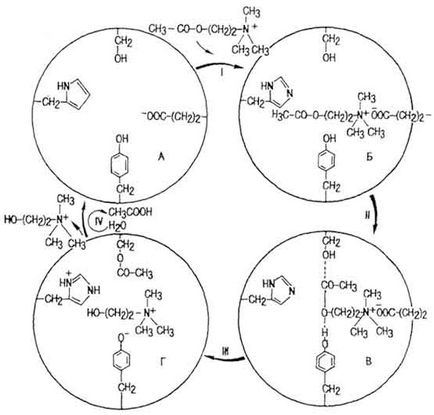
Мал. 42. Механізм дії холінестерази (по Ю. Б. Пилиповичу)
при взаємодії АХЕ з медіатором нервового збудження ацетилхоліном (AX) виникає комплекс фермент - AX (рис. 42, Б). На II етапі комплекс активується в результаті взаємодії залишків серину і тирозину активного центру і молекули AX (рис. 42, В). Енергетичний бар'єр знижується (виникає ES *). На III етапі під впливом радикала гистидина відтягується протон від гідроксилу тирозину, формується складноефірний зв'язок між залишком серину і ацетильной групою AX, розривається зв'язок між залишком оцтової кислоти і залишком холіну (рис. 42, Л. На IV етапі відбувається гідроліз ЕS * -комплексу. відновлюється активний центр АХЕ, виділяються холін і оцтова кислота. Гідроліз AX протікає з величезною швидкістю. Так, порція AX 1-2 мкг руйнується за 0, 1-0, 2 мс.
Кінетика ферментативних реакцій. Кожна хімічна реакція протікає з певною швидкістю. Біологічне призначення ферментів полягає в направленому підвищенні швидкості хімічних реакцій. Ці процеси вивчає ферментативна кінетика.
Ферментативна кінетика - розділ хімічної кінетики, що вивчає залежність швидкостей ферментативних реакцій від хімічної природи реагуючих речовин (субстратів, ферментів) і умов їх взаємодії (концентрації компонентів, рН, складу середовища, температури, дії активаторів або інгібіторів і ін.). Її положення дозволяють давати оцінку ферментативним процесам і направлено впливати на їх перебіг. Зупинимося на основних.
Розрізняють декілька типів ферментативних реакцій: незворотні реакції з одним субстратом, оборотні реакції з одним субстратом, незворотні реакції з двома субстратами і т. Д. Найбільш поширені незворотні реакції з одним субстратом.
В останньому випадку фермент E спочатку реагує з субстратом S, що призводить до утворення фермент-субстратного комплексу ES (у багатьох реакціях-двох і більше комплексів). Фермент-субстратної комплекс характеризується константою швидкості реакції його утворення k + 1 і константою швидкості реакції розпаду k-1.
Фермент-субстратному комплексу властива Субстратна константа, або константа дисоціації Ks.
Величина субстратной константи залежить від природи субстрату і ферменту. При однакових вихідних концентраціях ферменту і субстрату концентрація комплексу [ES] буде тим більше, чим менше величина Кs.
Субстратна константа визначає ступінь спорідненості ферменту і субстрату. Так, для інвертази Ks = 0,0167. Тут концентрація ферментсубстратного комплексу перевищує концентрацію вільних ферменту і субстрату приблизно в 60 разів.
У другій фазі ферментативного каталізу фермент-субстратної комплекс розпадається на фермент E і продукт реакції P.
Обидві фази ферментативного каталізу об'єднані в систему, типову для необоротних реакцій з одним субстратом:
В системі k + 2 позначає константу швидкості розпаду фермент-субстратного комплексу на фермент і продукт реакції P.
Для повної характеристики ферментативного процесу використовується константа Міхаеліса Km. Вона виражає відношення констант трьох реакцій, показаних в системі
Числове вираження Кm завжди трохи більше, ніж Ks. Так, значення Ks для фермент-субстратного комплексу сахараза - сахароза одно 0,0167, а величина Кт - 0,0280 моль / л. Кт для різних ферментів неоднакова.
Швидкість ферментативних реакцій висловлюють в катали (кат). Катав - каталітична активність ферменту, здатна здійснювати реакцію зі швидкістю, що дорівнює 1 моль / с в заданій системі вимірювання активності. Часто застосовуються похідні катала -мікрокаталі (мкат), нанокаталі (нкат) або пікокаталі (пкат), чому відповідають швидкості реакцій, що виражаються в мікромолі, наномолях і пікомоль в секунду.
Швидкість ферментативної реакції визначається умовами її протікання. Так, при оптимальних умовах (повне насичення ферменту субстратом, потрібний рН, температура 25 або 37 ° С) вона буде максимальна, або початкова, і позначається символом V. Така швидкість характеризується константою швидкості розпаду фермент-субстратного комплексу і концентрацією ферменту:
Для ферментативної реакції, яка протікає при недостатньому насиченні ферменту субстратом, характерна спостерігається швидкість # 957 ;. Вона визначається твором константи швидкості розпаду фермент-субстратного комплексу з утворенням продукту реакції P і концентрації фермент-субстратного комплексу:
Якщо врахувати, що
Таким чином, швидкість ферментативної реакції прямо пропорційна константі швидкості розпаду фермент-субстратного комплексу з утворенням продукту реакції, концентрацій ферменту, субстрату і обернено пропорційна субстратной константі.
Для стаціонарної стадії реакції концентрація [ES] постійна. Якщо [S]> [E], то
Застосовуючи константу Міхаеліса, можна спростити рівняння:
Спостережувану швидкість реакції можна виразити рівнянням
При збільшенні концентрації субстрату [S], коли [S]> Km.
Тут швидкість ферментативної реакції прагне до максимальної. Швидкість реакції можна охарактеризувати рівнянням Міхаеліса - Ментена:
З рівняння випливає, що при незначній концентрації субстрату швидкість ферментативної реакції лінійно залежить від [S], а при дуже високій концентрації субстрату вона прагне до максимальної швидкості Vm і вже не змінюється зі збільшенням [S]. Рівняння також показує, що при збереженні
рівня [S]> [E] швидкість реакції пропорційна концентрації ферменту E.