У 1903 р В. Генрі зробив висновок про те, що необхідною стадією ферментативного каталізу є з'єднання ферменту з субстратом, в результаті чого утворюється фермент-субстратної комплекс. Розвиток цієї ідеї призвело до створення загальної теорії дії ферментів; особливо великий внесок в неї в 1913р. внесли Л. Міхаеліс та М. Ментен. Відповідно до їхніх гіпотезі процес ферментативного каталізу можна розділити на 3 стадії:
1) дифузія субстрату до ферменту і стерическое зв'язування його з активним центром ферменту, тобто освіту фермент-субстратного комплексу (ES);
2) перетворення первинного комплексу в один або кілька активованих фермент-субстратні комплексів (ES *, ES ** ...);
3) відділення продуктів (Р) реакції від активного центру і дифузія його в навколишнє середовище.
Перша стадія зазвичай нетривала і залежить від концентрації субстрату в середовищі, а також його дифузії до активного центру ферменту. Комплекс утворюється практично миттєво. Субстрат приєднується до активного центру в декількох точках, утворюючи хелатні (клешневідние) комплекси. Приєднання здійснюється зв'язками різного характеру, в основному слабкими (водневі, електростатичні, гідрофобні, координаційні), ковалентні зв'язки зустрічаються рідко. На цій стадії зміна енергії активації незначно, орієнтація субстрату і активного центру сприяє їхньому зближенню і проходженню реакції.
Друга стадія найбільш повільна і лімітує швидкість всього каталізу в цілому. Її тривалість залежить від енергії активації даної хімічної реакції. На цій стадії відбувається розхитування зв'язків субстрату, їх розрив або утворення нових зв'язків в результаті взаємодії з активними групами ферменту. Завдяки утворенню активованих перехідних комплексів знижується енергія активації реакції.
Третя стадія практично миттєва. Вона визначається швидкістю дифузії продуктів реакції в навколишнє середовище.
Природа сил, що стабілізують різні конформаційні стану ферментсубстратного комплексу
Оборотні молекулярні взаємодії в біологічних системах опосередковуються силами трьох типів. Складання макромолекул в складну структуру, зв'язування субстрату з ферментом, міжклітинні взаємодії, тобто все молекулярні взаємодії в біологічних системах, здійснюються завдяки освіті водневих зв'язків, а також зв'язків, обумовлених електростатичними і вандерваальсовимі взаємодіями. Ці три основних типи нековалентних зв'язків розрізняються по своїй геометрії, енергії і специфічності. Більш того, хоча на них всегдасільно впливає присутність води, однак цей ефект проявляється по-різному. Розглянемо докладніше кожен з цих основних типів зв'язків.
електростатичні взаємодії
Заряджена група субстрату може реагувати з групою ферменту, що несе протилежний заряд. Сила такого електростатичного взаємодії визначається законом Кулона:
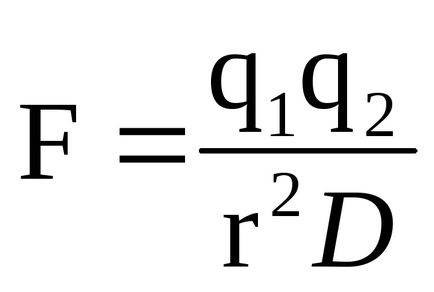
де q1 і q2 - заряди відповідних груп, r - відстань між ними, D-діелектрична постійна середовища. Електростатичне взаємодія найбільш сильно проявляється в вакуумі (де D = 1) і найбільш слабо - в такому середовищі, як вода (де D = 80).
Прикладом електростатичного взаємодії може служити зв'язування гліцил-L-тирозину з карбоксипептидази А - протеолітичних ферментів, який відщеплює С-кінцеві залишки амінокислот. Негативно заряджена кінцева карбоксильна група діпептідного субстрату взаємодіє з позитивно зарядженої гуанідинового групою аргініновая залишку на ферменті. Відстань між цими двома протилежно зоря-женнимі групами становить 0,28 нм:
Такий тип взаємодії називають також іонним зв'язком. сольовий зв'язком. сольовим містком або іонної парою. Всі ці терміни мають одне і те ж значення: електростатічeскoe взаємодія між протилежно зарядженими групами. Між негативнозарядженим субстратом і позитивно зарядженої бічним ланцюгом лізінових або аргініновая залишку можуть виникати електростатичні взаємодії. Якщо величини рК імідазольної групи залишку гістидину або кінцевий аміногрупи поліпептидного ланцюга забезпечують їх позитивний заряд при цьому рН середовища, то вони також можуть функціонувати як потенційні ділянки зв'язок-вання негативно зарядженого субстрату. У разі якщо субстрат має позитивний заряд, потенційними ділянками зв'язування служать негативно заряджені карбоксильні групи аспартату та глутамату, а також кінцева карбоксильна група поліпептидного ланцюга.