До сих пір ми говорили про тиск якого-небудь одного газу - кисню, водню і т. П. Але в природі і в техніці ми дуже часто маємо справу з сумішшю декількох газів. Найважливіший приклад цього - повітря, що є сумішшю азоту, кисню, аргону, вуглекислого газу та інших газів.
Газовою сумішшю розуміється суміш окремих газів, що вступають між собою ні в які хімічні реакції. Кожен газ (компонент) в суміші незалежно від інших газів повністю зберігає всі свої властивості і веде себе так, як якщо б він один займав весь об'єм суміші.
Від чого залежить тиск суміші газів?
Помістимо в колбу шматок вещест-ва, хімічно зв'язує кисло-род з повітря (наприклад, фосфор), і швидко закриємо колбу пробкою з труб-кою. приєднаної до ртутного манометру. Через деякий час весь кисень повітря з'єднається з фосфором. Ми побачимо, що манометр покаже менший тиск, ніж до видалення кисню. Значить, присутність кисню в повітрі збільшує його тиск.
Точне дослідження тиску суміші газів було вперше вироблено англійським хіміком Джоном Дальтоном в 1809 р
Встановив (1803 г.) закон кратних відносин, ввів поняття «атомна вага», першим визначив атомні ваги (маси) ряду елементів. Відкрив газові закони, названі його ім'ям.
Вважається, що перше точний опис колірної сліпоти дав в 1794 р англійський хімік Дальтон, а точніше - Долтон (John Dalton). Тому даними аномалій було дано назву "дальтонізм".
Англієць Джон Дальтон, незважаючи на своє відхилення, прожив 78 років.
У нього були три брати і одна сестра, двоє братів теж страждали цветослепотой на червоний колір.
У той час ще нічого не знали про генах і закони, які керують спадковістю, але Дальтон дуже докладно описав свій сімейний дефект і своє сприйняття світу. Завдяки опису свого дефекту, його ім'я вже 200 років відомо кожному школяру.
Історія багато разів вчила нас, що всі геніальні люди сприймали навколишній світ, природу і явища не так, як всі. Саме їм ми зобов'язані нових відкриттів і винаходів.
Цветослепие на один колір і люди зі зниженим колірним зором сприймають фарби навколишнього їх світу інакше, але часто не помічають своєї відмінності від інших. Чи не помічають його іноді і навколишні. Так, Дальтон, яка не розрізняв червоний колір, не знав про свою колірної сліпоти до 26 років.
Прагнучи зрозуміти, чому гази в атмосфері становлять суміш з певними фізичними властивостями, а не розташовуються один під одним шарами відповідно до своєї щільності, він встановив, що поведінка даного газу не залежить від складу суміші; сформулював закон парціальних тисків газів, виявив залежність розчинності газів від їх парціального тиску.
Тиск, який мав би кожен з газів, що складають суміш, якби видалити інші гази з обсягу, займаного сумішшю, називають парціальним тиском цього газу. Дальтон знайшов, що тиск суміші газів дорівнює сумі парціальних тисків їх компонентів (закон Дальтона).
Закон Дальтона говорить: Тиск суміші дорівнює сумі парціальних тисків газів, що утворюють суміш. . Тиску називається парціальними.
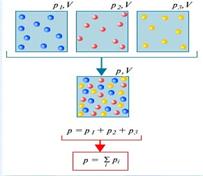
Розглянемо газ, що складається з молекул різних речовин, який знаходиться в обсязі V. Внаслідок хаотичного теплового руху молекули кожної компоненти суміші будуть розподілені за обсягом рівномірно, тобто так як якщо б інші компоненти газу були відсутні. Через постійні зіткнень молекул один з одним, що супроводжуються частковим обміном між ними імпульсами і енергіями, в суміші встановлюється теплова рівновага. Все це призводить до того, що тиск кожної з компонент суміші не буде залежати від присутності інших.
Тоді результуючий тиск визначається сумарним тиском всіх компонентів.
Зауважимо, що до сильно стиснутим газам закон Дальтона непридатний, так само як і закон Бойля - Маріотта.
Перший початок термодинаміки (ПНТ)
Припустимо, що деяка термодинамічна система (наприклад, газ, укладений в циліндр під поршнем), володіючи внутрішньою енергією U1, отримала деяку кількість теплоти Q і, перейшовши в новий стан, що характеризується внутрішньою енергією U2, зробила роботу А над зовнішнім середовищем, тобто . проти зовнішніх сил. В цьому випадку Q = U2-U1 + A або
Рівняння (4) висловлює ПНТ: теплота, що повідомляється системі, витрачається на зміну її внутрішньої енергії і на здійснення нею роботи проти зовнішніх сил.
Для нескінченно малих процесів вираз (4) записують в диференціальної формі dQ = dU + dA або в більш коректній формі
оскільки тільки dU є повним диференціалом, а d Q і d А повними диференціалами не є.
З формули (5) випливає, що в СІ кількість теплоти виражається в тих же одиницях, що робота і енергія, тобто в джоулях (Дж).
Якщо система періодично повертається в первісний стан, то зміна її внутрішньої енергії D U = 0. Тоді, згідно з (4) А = Q. тобто вічний двигун першого роду, який здійснював би велику роботу, ніж повідомлена йому ззовні енергія, неможливий. Це одне з формулювань першого початку термодинаміки.