(*) Ця класифікація умовна, оскільки одні й ті ж гормони можуть виконувати різні функції
119. Будова, синтез і метаболізм іодтіронінов. Вплив на обмін ве-вин. Зміна метаболізму при гіпо- та гіпертиреозі. Причини і прояв ендемічного зобу.
Біосинтез йодтиронінів. Йодтироніни синтезуються в складі білка тиреоглобуліну (ТГ) в фолікулах, які представляють собою морфологічну і функціональну одиницю щитовидної залози.
Тиреоглобулін синтезується на рибосомах шорсткого ЕР у вигляді претіреоглобуліна, потім переноситься в цистерни ЕР, де відбувається формування вторинної та третинної структури, включаючи процеси глікозилювання. З цистерн ЕР Тиреоглобулін надходить в апарат Гольджі, включається до складу секреторних гранул і секретується в позаклітинний колоїд, де відбувається йодування залишків тирозину і утворення йодтиронінів. Йодування тиреоглобуліну і освіту йодтиронінів здійснюється в кілька етапів
Транспорт йоду в клітини щитовидної залози. Йод у вигляді органічних і неорганічних сполук надходить в шлунково-кишковому тракті з їжею та питною водою. Добова потреба в йоді становить 150-200 мкг. 25-30% цієї кількості йодидів захоплюється щитовидною залозою. Транспорт йодиду в клітини щитовидної залози - енергозалежний процес і відбувається за участю спеціального транспортного білка проти електрохімічного градієнта (співвідношення концентрацій I - в залозі до концентрації I - в сироватці крові в нормі становить 25: 1). Робота цього йодид-переносить білка пов'язана з Nа +, К + -АТФ-азой.
Окислення йоду. Окислення I - в I + відбувається за участю гемсодержащих тіреопероксі-дази і Н2 О2 в якості окислювача. Йодування тирозину. Окислений йод взаємодіє з залишками тирозину в молекулі тиреоглобуліну. Ця реакція також каталізується тіреопероксідазе.
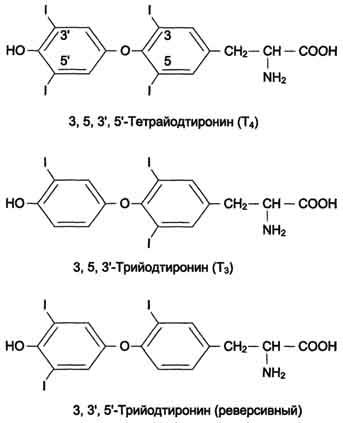
Освіта йодтиронінів. Під дією тіреопероксідазе окислений йод реагує з залишками тирозину з утворенням монойод-тирозин (МІТ) і дійодтірозіна (ДІТ). Дві молекули ДІТ конденсуються з утворенням йодтироніни Т4. а МІТ і ДІТ - з утворенням йодтироніни Т3. Йодтиреоглобуліном транспортується з колоїду в фолікулярну клітку шляхом ендоцитозу і гідролізується ферментами лізосом із звільненням Т3 і Т4. У нормальних умовах щитовидна залоза сек-Ретіро 80-100 мкг Т4 і 5 мкг Т3 на добу. Ще 22-25 мкг Т3 утворюється в результаті дейодування Т4 в периферичних тканинах по 5'-вуглецевого атома.
Транспорт і метаболізм йодтиронінів. Від половини до двох третин Т3 і Т4 знаходяться в організмі поза щитовидної залози. Велика частина їх циркулює в крові в пов'язаної формі в комплексі з білками: тироксинзв'язуючого глобуліном (ТСГ) і тироксинзв'язуючого преальбуміном (ТСПА). ТСГ служить основним транспортним білком йодтиронінів, а також формою їх депонування. Він має більш високу спорідненість до Т3 і Т4 і в нормальних умовах пов'язує майже все кількість цих гормонів. Тільки 0,03% Т4 і 0,3% Т3 знаходяться в крові у вільній формі. Т1 / 2 Т4 в плазмі в 4-5 разів більше, ніж Т3. Для Т4 цей період становить близько 7 днів, а для Т3 - 1-1,5 дня. Біологічна активність йодтиронінів обумовлена незв'язаної фракцією. Т3 - основна біологічно активна форма йодтиронінів; його спорідненість до рецептора клітин-мішеней в 10 разів вище, ніж у Т4. У периферичних тканинах в результаті дейодування частини Т4 по п'ятому вуглецевого атома утворюється так звана "реверсивна" форма Т3. яка майже повністю позбавлена біологічної активності. Інші шляхи метаболізму йодтиронінів включають повне дейодирование, дезаминирование або декарбоксилирование. Йодовані продукти катаболізму йодтиронінів кон'югують-ся в печінці з глюкуроновою або сірчаною кислотами, секретируются з жовчю, у кишечнику знову всмоктуються, дейодіруется в нирках і виділяються з сечею.
Механізм дії і біологічні функції йодтиронінів. Клітини-мішені йодтиронінів мають 2 типи рецепторів до цих гормонів. Основні ефекти йодтиронінів - результат їх взаємодії з високоспеціфічнимі рецепторами, які в комплексі з гормонами постійно знаходяться в ядрі і взаємодіють з певними послідовностями ДНК, беручи участь в регуляції експресії генів. Інші рецептори розташовані в плазматичній мембрані клітин, але це не ті ж самі білки, що в ядрі. Вони мають більш низьку спорідненість до йодтироніни і, ймовірно, забезпечують зв'язування гормонів для утримання їх в безпосередній близькості до клітки. При фізіологічної концентрації йодтиронінів їх дія проявляється в прискоренні білкового синтезу, стимуляції процесів росту і клітинної диференціювання. В цьому відношенні йодтироніни - синергисти гормону росту. Крім того, Т3 прискорює транскрипцію гена гормону росту. У тварин при дефіциті Т3 клітини гіпофіза втрачають здатність до синтезу гормону росту. Дуже високі концентрації Т3 гальмують синтез білків і стимулюють катаболические процеси, показником чого є негативний баланс азоту. Метаболічні ефекти йодтиронінів відносять в основному до енергетичного метаболізму, що проявляється в підвищенні поглинання клітинами кисню. Цей ефект проявляється у всіх органах, крім мозку, РЕМ і гонад. У різних клітинах Т3 стимулює роботу Nа +, К + -АТФ-ази, на що витрачається значна частина енергії, утилизируемой кліткою. У печінки йодтироніни прискорюють гліколіз, синтез холестеролу і синтез жовчних кислот. У печінці і жировій тканині Т3 підвищує чутливість клітин до дії адреналіну і побічно стимулює ліполіз в жировій тканині і мобілізацію глікогену в печінці. У фізіологічних концентраціях Т3 збільшує в м'язах споживання глюкози, стимулює синтез білків і збільшення м'язової маси, підвищує чутливість м'язових клітин до дії адреналіну. Йодтироніни також беруть участь у формуванні відповідної реакції на охолодження збільшенням теплопродукції, підвищуючи чутливість симпатичної нервової системи до норадреналіну і стимулюючи секрецію норадреналіну.
Захворювання щитовидної залози Гормони щитовидної залози необхідні для нормального розвитку людини.
Гіпотиреоз у новонароджених призводить до розвитку кретинізму, який проявляється множинними вродженими вадами і важкої незворотною затримкою розумового розвитку. Гіпотиреоз розвивається внаслідок недостатності йодтиронінів. Зазвичай гіпотиреоз пов'язаний з недостатністю функції щитовидної залози, але може виникати і при захворюваннях гіпофіза і гіпоталамуса.
Найбільш важкі форми гіпотиреозу, що супроводжуються слизових набряком шкіри і підшкірної клітковини, позначають терміном "мікседема" (від грец. Туха - слиз, oedema - набряк). Набряклість обумовлена надмірним накопиченням глікозаміногліканів і води. В підшкірній клітковині накопичується глюкуроновая і в меншій мірі хондроітинсірчана кислоти. Надлишок гликозаминогликанов викликає зміни колоїдної структури міжклітинної матриксу, підсилює його гідрофільність і пов'язує іони натрію, що призводить до затримки води. Характерні прояви захворювання: зниження частоти серцевих скорочень, млявість, сонливість, непереносимість холоду, сухість шкіри. Ці симптоми розвиваються внаслідок зниження основного обміну, швидкості гліколізу, мобілізації глікогену і жирів, споживання глюкози м'язами, зменшення м'язової маси і зниження теплопродукції. При виникненні гіпотиреозу у дітей старшого віку спостерігають відставання в рості без затримки розумового розвитку. В даний час у дорослих людей частою причиною гіпотиреозу є хронічний аутоімунний тиреоїдит, що приводить до порушення синтезу йодтиронінів (зоб Хашимото).
Гіпертиреоз виникає внаслідок підвищеної продукції йодтиронінів. Дифузний токсичний зоб (базедова хвороба, хвороба Грейвса) - найбільш поширене захворювання щитовидної залози. При цьому захворюванні відзначають збільшення розмірів щитовидної залози (зоб), підвищення концентрації йодтиронінів в 2-5 разів і розвиток тиреотоксикозу. Характерні ознаки тиреотоксикозу: збільшення основного обміну, почастішання серцебиття, м'язова слабкість, зниження маси тіла (не дивлячись на підвищений апетит). пітливість, підвищення температури тіла, тремор і екзофтальм (витрішкуватість). Ці симптоми відображають одночасну стимуляцію йодтироніни як анаболічних (зростання і диференціювання тканин), так і катаболічних (катаболізм вуглеводів, чи-пидов і білків) процесів. Більшою мірою посилюються процеси катаболізму, про що свідчить негативний баланс азоту. Гіпертиреоз може виникати в результаті різних причин: розвиток пухлини, тиреоїдит, надмірне надходження йоду і йодсодер-службовців препаратів, аутоімунні реакції. Хвороба Грейвса виникає в результаті утворення антитіл до тиреоїдних антигенів. Один з них, імуноглобулін (IgG), імітує дію тиреотропина, взаємодіючи з рецепторами тиреотропіну на мембрані клітин щитовидної залози. Це призводить до дифузного розростання щитовидної залози і надмірної неконтрольованою продукції Т3 і Т4. оскільки освіту IgG не регулюється за механізмом зворотного зв'язку. Рівень ТТГ при цьому захворюванні знижений внаслідок пригнічення функції гіпофіза високими концентраціями йодтиронінів.
120. Регуляція енергетичного метаболізму, роль інсуліну і контрінсулярних гормонів в забезпеченні гомеостазу.
Зміни метаболізму в печінці в абсорбтивной періоді
Після прийому їжі печінка стає головним споживачем глюкози, що надходить з травного тракту. Майже 60 з кожних 100 г глюкози, що транспортується портальної системою, затримується в печінці. Збільшення споживання печінкою глюкози - не результат прискорення її транспорту в клітини (транспорт глюкози в клітини печінки не стимулюється інсуліном), а наслідок прискорення метаболічних шляхів, в яких глюкоза перетворюється в депоновані форми енергоносіїв: глікоген і жири. При підвищенні концентрації глюкози в гепатоцитах відбувається активація глюкокинази, що перетворює глюкозу в глюкозо-6-фосфат. Глюкокіназа має високе значення Кm для глюкози, що забезпечує високу швидкість фосфорилювання при високих концентраціях глюкози. Крім того, глюкокіназа не інгібує глюкозо-6-фосфатом (див. Розділ 7). Інсулін індукує синтез мРНК глюкокинази. Підвищення концентрації глюкозо-6-фосфату в гепатоцитах обумовлює прискорення синтезу глікогену. Цьому сприяють одночасна інактивація глікогенфосфорилази і активація глікогенсінтази. Під впливом інсуліну в гепатоцитах прискорюється гліколіз в результаті підвищення активності і кількості ключових ферментів: глюкокинази, фосфофруктокинази і піруваткінази. У той же час відбувається гальмування глюконеогенезу в результаті інактивації фруктозо-1,6-бісфосфатази і зниження кількості фосфоенолпіруваткарбоксікінази - ключових ферментів глюконеогенезу. Підвищення концентрації глюкозо-6-фосфату в гепатоцитах в абсорбтивной періоді, поєднується з активним використанням NADPH для синтезу жирних кислот, що сприяє стимуляції пентозофосфатного шляху. Прискорення синтезу жирних кислот забезпечується доступністю субстратів (ацетил-КоА і NADPH), що утворюються при метаболізмі глюкози, а також активацією і індукцією ключових ферментів синтезу жирних кислот. У абсорбтивной періоді в печінці прискорюється синтез білків. Однак кількість амінокислот, що надходять в печінку з травного тракту, перевищує можливості їх використання для синтезу білків і інших азотовмісних сполук. Надлишок амінокислот або надходить у кров і транспортується в інші тканини, або дезамінується з подальшим включенням безазотистих залишків в загальний шлях катаболізму.
Зміни метаболізму в адипоцитах. Основна функція жирової тканини - запасання енергоносіїв в формі тріацілглі-церола. Під впливом інсуліну прискорюється транспорт глюкози в адипоцити. Підвищення внутрішньоклітинної концентрації глюкози і активація ключових ферментів гліколізу забезпечують утворення ацетил-КоА і гліцерол-3-фосфату, необхідних для синтезу ТАГ. Стимуляція пентозофосфатного шляху забезпечує утворення NADPH, необхідного для синтезу жирних кислот. Однак біосинтез жирних кислот de novo в жировій тканині людини протікає з високою швидкістю тільки після попереднього голодування. При нормальному ритмі харчування для синтезу ТАГ використовуються в основному жирні кислоти, що надходять з ХМ і ЛПДНЩ під дією ЛП-ліпази. Разом з тим при збільшенні відносини інсулін / глюкагон гормончувствітельной ТАГ-ліпаза знаходиться в дефосфорілірованном неактивній формі, і процес ліполізу гальмується.
Зміна метаболізму в м'язах в абсорбтивной періоді. У абсорбтивной періоді під впливом інсуліну прискорюється транспорт глюкози в клітини м'язової тканини. Глюкоза фосфорилюється і окислюється для забезпечення клітини енергією, а також використовується для синтезу глікогену. Жирні кислоти, що надходять з ХМ і ЛПДНЩ, в цей період відіграють незначну роль в енергетичному обміні м'язів. Потік амінокислот в м'язи і біосинтез білків також збільшуються під впливом інсуліну, особливо після прийому білкової їжі.