Одним з найбільш поширених в хімічній практиці методів прискорення хімічних реакцій є каталіз.Каталізатор - речовина, яка багаторазово бере участь у проміжних стадіях реакції, але виходить з неї хімічно незмінним.
Наприклад, для реакції А2 + В2 = 2АВ
участь каталізатора К можна виразити рівнянням
Ці рівняння можна представити кривими потенційної енергії (рис. 5.2.).
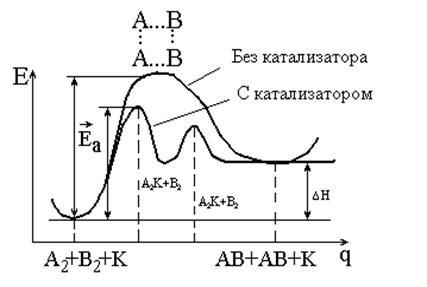
Мал. 5.2. Енергетична схема перебігу реакції
з каталізатором і без каталізатора
З малюнка 5.2 видно, що:
1) каталізатор зменшує енергію активації, змінюючи механізм реакції, - вона протікає через нові стадії, кожна з яких характеризується невисокою енергією активації;
2) каталізатор не змінює DН реакції (а також DG, DU і DS);
3) якщо катализируемая реакція оборотна, каталізатор не впливає на рівновагу, не змінює константу рівноваги і рівноважні концентрації компонентів системи. Він в рівній мірі прискорює і пряму, і зворотний реакції, тим самим прискорюючи час досягнення рівноваги.
Очевидно, в присутності каталізатора енергія активації реакції знижується на величину DЕк. Оскільки в вираженні для константи швидкості реакції (рівняння 5.10) енергія активації входить в негативний показник ступеня, то навіть невелике зменшення Еа викликає дуже велике збільшення швидкості реакції:.
Вплив каталізатора на зниження Еа можна показати на прикладі реакції розпаду йодиду водню:
Таким чином, для даної реакції зменшення енергії
активації на 63 кДж, тобто в 1,5 рази, відповідає підвищенню швидкості реакції при 500 К більш ніж 10 6 разів.
Слід зазначити, що предекспоненціальний множник каталітичної реакції k0 1 цієї статті не дорівнює k0 і зазвичай значно менше, проте відповідне зменшення швидкості далеко не компенсує її збільшення за рахунок Еа.
Приклад 5. Енергія активації деякої реакції за відсутності каталізатора дорівнює 75,24 кДж / моль, а з каталізатором - 50,14 кДж / моль. У скільки разів зростає швидкість реакції в присутності каталізатора, якщо реакція протікає при 25 0 С, а предекспоненціальний множник в присутності каталізатора зменшується в 10 разів.
Рішення. Позначимо енергію активації реакції без каталізатора через Еа. а в присутності каталізатора - через Еа 1; відповідні константи швидкостей реакцій позначимо через k і k 1. Використовуючи рівняння Арреніуса (5.9) (див. розділ 5.3) і приймаючи k0 1 / k0 = 10, знаходимо:
Таким чином, зниження енергії активації каталізатором на 25,1 кДж призвело до збільшення швидкості реакції в 2500 разів, незважаючи на 10-кратне зменшення предекспоненціальний множника.
Каталітичні реакції класифікуються за типом каталізаторів і за типом реакцій. Так, наприклад, по агрегатному стані каталізаторів і реагентів каталіз підрозділяється на гомогенний (каталізатор і реагент утворюють одну фазу) і гетерогенний (каталізатор і реагенти - в різних фазах, є межа розділу фаз між каталізатором і реагентами).
Прикладом гомогенного каталізу може бути окислення СО до СО2 киснем в присутності NO2 (каталізатор). Механізм каталізу можна зобразити наступними реакціями:
і каталізатор (NO2) знову бере участь в першій реакції.
Аналогічно цьому може бути каталізувати реакція окислення SO2 в SO3; подібна реакція застосовується у виробництві сірчаної кислоти "нітрозним" способом.
Прикладом гетерогенного каталізу є отримання SO3 з SO2 в присутності Pt або V2 O5:
Ця реакція також застосовується у виробництві сірчаної кислоти ( "контактний" метод).
Гетерогенний каталізатор (залізо) застосовується також у виробництві аміаку з азоту і водню і в багатьох інших процесах.
Ефективність гетерогенних каталізаторів зазвичай набагато більше, ніж гомогенних. Швидкість каталітичних реакцій в разі гомогенного каталізатора залежить від його концентрації, а в разі гетерогенного - від його питомої поверхні (тобто дисперсності) - чим вона більша, тим більше швидкість. Останнє пов'язано з тим, що каталітична реакція йде на поверхні каталізатора і включає в себе стадії адсорбції (прилипання) молекул реагентів на поверхні; після закінчення реакції її продукти десорбируются. Для збільшення поверхні каталізаторів їх подрібнюють або отримують спеціальними способами, при яких утворюються дуже тонкодисперсні порошки.
Наведені приклади одночасно є прикладами окислювально-відновного каталізу. У цьому випадків якості каталізаторів зазвичай виступають перехідні метали або їх сполуки (Mn 3+. Pt, Au, Ag, Fe, Ni, Fe2 O3 і ін.).
В кислотно-основному каталізі роль каталізатора виконують Н +. ВІН - і інші подібні частинки - носії кислотності і основності. Так, реакція гідролізу
прискорюється приблизно в 300 разів при додаванні будь-який з сильних кислот: HCl, HBr або HNO3.
Велике значення каталіз має в біологічних системах. В цьому випадку каталізатор називають ферментом. Ефективність дії багатьох ферментів набагато більше, ніж звичайних каталізаторів. Наприклад, для реакції зв'язування азоту в аміак
в промисловості використовується гетерогенний каталізатор у вигляді губчастого заліза з добавками оксидів і сульфатів металів.
При цьому реакція проводиться при Т »700 К і Р» 30 МПа. Цей же синтез йде в бульбах бобових рослин під дією ферментів при звичайних Т і Р.
Каталітичні системи небайдужі до домішкам і добавкам. Деякі з них збільшують ефективність каталізу, як наприклад, в наведеному вище прикладі каталізу синтезу аміаку залізом. Такі добавки в каталізатор називаються промоторами (оксиди калію та алюмінію в залозі). Деякі домішки, навпаки, пригнічують каталітичну реакцію ( "отруюють" каталізатор), це каталітичні отрути. Наприклад, синтез SO3 на Pt-каталізаторі дуже чутливий до домішкам, що містить сульфидную сірку; сірка отруює поверхню платинового каталізатора. І навпаки, каталізатор на основі V2 O5 малочувствітелен таких домішок; честь розробки каталізатора на основі оксиду ванадію належить російському вченому Г.К. Борескова.