
Основи для більш адекватного опису реальності заклали шведський хімік Карл Шеєле і його англійський колега Джозеф Прістлі, які, розділяючи ті чи інші складні сполуки нагріванням, отримали «горючий повітря», в якому полум'я свічки горіло куди яскравіше звичайного. Шеєле пішов ще далі: він показав, що при згорянні речовин в ізольованому посудині кількість повітря зменшується приблизно на двадцять відсотків, при цьому в останньому повітрі горіння неможливо. Однак прихильність до теорії флогістону змушувала цих видатних вчених придумувати ті чи інші пояснення очевидних фактів в рамках усталеної догми. Першим, хто, провівши серію дослідів, запропонував нову теорію горіння, заявивши, що повітря складається з двох частин - горючої (кисень) і інертною (азот), - а речовина, згораючи, з'єднується з киснем, пов'язуючи його, був Лавуазьє. Шляхом точних зважувань він встановив, що маса продуктів горіння завжди більша за масу вихідної речовини. У той же час маса запаяної колби, в якій він спалював ті чи інші реагенти не змінювалася. У сукупності з встановленим Шеєле фактом зменшення кількості повітря в процесі горіння, Лавуазьє і зробив висновок про те, що реакционноспособна частина повітря зв'язується з вихідною речовиною, утворюючи продукти горіння. Так були відкриті кисень і азот.
Тим часом пройшло багато років, перш ніж ці гази змогли використовувати в промислових масштабах. Протягом перших двох третин XIX століття кисень одержували в дуже незначних кількостях лабораторними методами, тому ні про яке його широкому застосуванні мова не йшла. Здавалося б, парадокс: атмосфера - цілий океан кисню та азоту, залишилося тільки знайти спосіб розділити ці два газу, і проблема їх отримання вирішена. У той же час найбільш природний спосіб поділу повітря на кисень і азот - за рахунок різниці температур кипіння, довгий час залишався недоступним. Перш за все, в силу необхідності глибокого охолодження повітря. Взагалі у свій час азот і кисень вважали «постійними» газами, тобто газами, які неможливо піддати зрідження. Хоча, звичайно, це відображало лише відсутність необхідних методів і технологій, а не якусь принципову особливість даних газів.
Таким чином, одним з основних перешкод на шляху промислового отримання атмосферних газів в чистому вигляді було недосконалість техніки охолодження. Одними з перших подолати даний бар'єр спробували польські фізики Ольшевський і Врублевський (Краківський університет) паралельно з Джеймсом Дьюара (Великобританія), які застосували каскадний принцип охолодження для скраплення кисню та азоту. Пізніше за допомогою цієї ж схеми Каммерлінг-Оннес (Нідерланди) отримав і рідке повітря. Суть методу полягає в послідовному зниженні температури за допомогою декількох рефрижераторів компресійного типу з різними робочими речовинами.
Принцип дії каскадного процесу можна простежити за допомогою рис. 1.
Спочатку газ, обраний в якості охолоджуючого агента, зріджують при кімнатній температурі шляхом сильного стиснення за допомогою компресора. Тепло, що виділяється при стисненні, відводиться системою водяного охолодження. Зріджений газ подається у випарник з більш низьким тиском, де кипить, відбираючи теплоту, вступаючи потім в компресор, де знову скраплюється. При цьому випарник першого ступеня є одночасно охолоджувальної ванній для зрідженого хдадагента другого ступеня. Природно, що для кожного ступеня підбирають холодоагент, температура кипіння якого відповідає необхідним рівням охолодження.
Мал. 1. парокомпрессионной рефрижератор: 1 - компресор; 2 - вода; 3 - бак системи охолодження; 4 - дросель; 5 - рідина; 6 - випарник (кріостат)
Каскадний процес зіграв важливу роль в історії отримання технічних газів, показавши принципову сжіжаемость повітря. Однак в подальшому він поступився місцем більш досконалим технологічними схемами.
Метод Лінде, запропонований цим німецьким фізиком в 1895 р заснований на ефекті Джоуля-Томпсона, який полягає в зміні температури газу при розширенні його через будь-яку гідродинамічний опір (дроселювання). Справа в тому, що внутрішня енергія реального газу складається з потенційної енергії тяжіння між частинками і кінетичної енергією їх хаотичного руху. При розширенні газу в умовах відсутності енергообміну із зовнішнім середовищем його потенційна енергія взаємодії молекул збільшується, так як збільшується відстань між ними. Зростання потенційної енергії, внаслідок «розтягування» молекул на більшу відстань один від одного, компенсується зменшенням їх кінетичної енергії (енергії теплового руху), а отже, і температури. Правда подібний ефект спостерігається тільки до певного температурного порога, вище якого він змінює знак: тепер при розширенні газ нагрівається. У цьому випадку просто змінює знак сама потенційна енергія. Якщо раніше (до певної температури) вона визначалася силами тяжіння, то тепер превалюють є сили відштовхування. І розширення (навпаки) надає додатковий імпульс теплового руху молекул. Подібний «звернений» ефект Джоуля-Томпсона при нормальних температурах характерний для водню.
Втім, повітря охолоджується шляхом дроселювання на досить великому температурному інтервалі, що і дозволило застосувати це його властивість в циклі Лінде. У ньому повітря стискається компресором до тиску 200 атмосфер, теплоту стиснення віддає в теплообміннику і закінчується через дросельний клапан, при цьому розширюючись і охолоджуючись. Охолоджене повітря протікає через той же теплообмінник, але з іншого боку, відбираючи тепло у новій порції стисненого газу, після чого сам надходить на стиснення. Циркулюючи таким чином досить довгий час, повітря охолоджується до такої температури, що при дроселюванні частина його починає скраплюватися. Втім, заслуга Лінде полягала не тільки в тому, що він зміг поставити на промислові рейки скраплення повітря, але в першу чергу в тому, що він розділив скраплений повітря, отримавши азот і кисень високого ступеня очищення.
Для цього він застосував подвійну ректифікацію отриманого рідкого повітря, так як проста перегонка не давала продукцію потрібної чистоти. Незважаючи на те, що температура кипіння кисню (-183 ° С) вище температури кипіння азоту (-196 ° С) на тринадцять градусів, повністю розділити ці гази простим випаровування азоту не вдавалося.
Сама ідея ректифікаційної колони складається в зустрічному русі рідини, збагаченої низкокипящим компонентом (в нашому випадку азотом), назустріч парам газової суміші, збагаченої висококиплячих компонентах (киснем). Рідина подається зверху колони, газова суміш випаровується з її нижньої частини.
Для збільшення поверхні контакту фаз застосовують так звані ректифікаційні тарілки. Стикаючись з ними, газ частково конденсується, а рідина частково випаровується. При цьому в рідкий стан переходить в основному висококипляча частина газу, а випаровується низькокипляча частина рідини. В результаті подібного обміну висхідний потік суміші газів збагачується низкокипящим компонентом, а спадний потік рідини - висококиплячих. У звичайних ректифікаційних колонах для створення зворотного потоку рідини частина отриманого на виході з колони низькокиплячого компонента конденсируют і направляють назад.
Проблема в тому, що рідкий повітря не вдається розділити «з наскоку». Застосовуючи навіть найефективніші ректифікаційні колони, ми можемо отримати на виході досить чистий азот, але внизу колони залишатиметься суміш азоту з киснем, хоча і збагачена останнім в порівнянні з початковим складом повітря.
Тому-то Лінде і запропонував схему подвійної перегонки. Коротенько опишемо відбуваються в них процеси (рис. 2).
- 1) У першу (нижню) ректифікаційної колони подається зріджений повітря, який в процесі перегонки розділяється на майже чистий азот і азотно-кисневу суміш.
- 2) Азот конденсується у верхній частині першої колони, звідки відбирається, прямуючи потім в рідкому вигляді в верхню частину другої (верхньої) колони, формуючи потік рідини, що стікає вниз.
- 3) азотно-киснева суміш подається в середню частину другої колони. Так як процес безперервний, там її вже чекають, з одного боку, потік газів з випарника, збагачене киснем, а з іншого - що стікає зверху рідина, збагачена азотом.
- 4) Потрапивши під такою «перехресний вогонь», азотно-киснева суміш починає розділятися відповідно до раніше описаними принципами. Вгору з газами в результаті йде чистий азот, а внизу збирається чистий кисень.
Витонченість запропонованої схеми полягає, крім усього іншого, в тому, що випарник другої колони є одночасно конденсатором для першої. Це дозволяє істотно скоротити витрату енергії. Тим часом необхідний температурний режим забезпечується різницею тисків у двох колонах і підтримується автоматично.
Паралельно з Лінде над поділом повітря роботах французький вчений Клод. При цьому для попереднього скраплення він використав не дросселирование, а детандери - машини, в яких газ, розширюючись, здійснював роботу і охолоджувався. Дана технологія виявилася менш ефективною, ніж запропонована Лінде, перш за все, через складнощі роботи механічних деталей при низькій температурі. Тим часом до початку тридцятих років в загальних рисах був розроблений турбодетандер, в якому повітря (або будь-який інший газ), розширюючись, обертає лопаті турбіни, за рахунок чого охолоджується з подальшим скраплення. Подібні пристрої навіть почали частково застосовуватися в промисловому виробництві, але мали досить низьким ККД. Прорив у використанні турбодетандеров забезпечив П. Л. Капіца, який запропонував, здавалося б, очевидну ідею, до якої, проте, ніхто до нього не додумався. Раніше для скраплення газів використовувалася турбіна, близька за характеристиками до парової. Капіца ж звернув увагу на те, що холодний стиснене повітря, що працює в ній, за властивостями ближче до рідини, ніж до пару. Це спонукало його взяти за прототип для нового турбодетандера водяну турбіну: ". Правильно обраний тип турбодетандера буде як би компромісом між водяний і паровою турбіною" - вважав Капіца. Це дійсно різко підвищило ККД скраплення газів, так що тепер саме турбодетандер, розроблений Капицею, є основою отримання рідкого повітря. Подальше ж його поділ йде за схемою, запропонованою ще Лінде.
Мал. 2. Апарат дворазовою ректифікації: 1, 2 - ректифікат колони; 3 - конденсатор-випарник
Складніше з аргоном. Його температура кипіння нижче, ніж у кисню, але вище, ніж у азоту. Тому частина його виходить з киснем, а інша частина - з азотом. Щоб запобігти подібному розвитку подій, з середньої частини колони відбирають деяку частку розташованої в ній суміші, направляючи її в додаткову колону поділу, звідки звільнена від аргону киснево-азотна суміш повертається назад, а концентрат аргону надходить на подальше очищення.
Відзначимо, що на сьогоднішній день, крім криогенного, існують і інші способи поділу газів.
Так, наприклад, адсорбційний спосіб характеризується низькою собівартістю, легкістю управління виробничим процесом і досить високим ступенем чистоти одержуваних газів. В основу даного способу покладено здатність деяких речовин специфічно (переважно) поглинати ті чи інші гази. При отриманні азоту, повітря під тиском подається в адсорбер, що містить вуглецеві молекулярні сита (рис. 3). В результаті кисень поглинається адсорбентом, а на виході отримуємо азот. У той же час обсяг кисню, який може поглинути адсорбент, обмежений, тому необхідно постійно проводити регенерацію молекулярних сит. Зазвичай це досягається скиданням тиску: кисень випаровується з поверхні адсорбенту, і останній готовий до розподілу нової партії повітря.
Для отримання кисню використовують той факт, що азот адсорбується на алюмосилікатних ситах швидше, ніж кисень. Тому, пропускаючи повітря через адсорбер з алюмосилікатних наповненням, на виході отримуємо кисень чистотою до 95%.
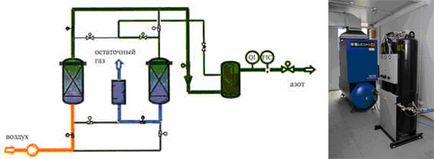
Мал. 3. Адсорбционное поділ газів:
а) схема отримання азоту з повітря адсорбційним методом;
б) установка для адсорбційного розділення газів
Мембранний спосіб поділу повітря - ще один метод отримання газів з атмосфери. Він заснований на тому, що складові повітря з різною швидкістю проходять через газопроникні мембрани, зазвичай полімерні (рис. 4). Повітря при цьому, подається під тиском в мембранний модуль, що складається з безлічі порожніх полімерних волокон з нанесеним на них газороздільних шаром. Молекули кисню і аргону «продавлюються» крізь мембрану назовні, а в волокнах залишається збагачена азотом газова суміш. Послідовне фільтрування повітря крізь кілька мембранних модулів дозволяє отримати досить чистий азот (до 99,9%).


Мал. 4. Мембранне поділ газів:
а) мембрани - порожнисті полімерні волокна;
б) установка для мембранного поділу
І мембранний і адсорбційний способи поділу повітря, дозволяючи отримати відносно чистий азот, не можуть, тим не менш, похвалитися виділенням кисню з потрібною для технічних цілей чистотою, не кажучи вже про аргоні і інших газах. Тому основним способом поділу газів на сьогоднішній день залишається метод кріогенної ректифікації, що дозволяє отримувати кінцеві продукти, практично вільні від домішок.