Для атома існує дві основні можливості підкоритися прави-лу октету. Перша з них - освіту іонної зв'язку. (Друга - освітньої-ня ковалентного зв'язку. Про неї мова піде нижче). При утворенні іон-ної зв'язку атом металу втрачає електрони, а атом неметалла набуває. Для прикладу розглянемо електронна будова атомів натрію і хлору:
Na 1s 2 2s 2 2p 6 3s 1 - один електрон на зовнішньому рівні
Cl 1s 2 2s 2 2p 6 3s 2 3p 5 - сім електронів на зовнішньому рівні
Якщо атом натрію передасть свій єдиний Зs-електрон атома хлору, правило октету буде виконано для обох атомів. У атома хлору виявиться вісім електронів на зовнішньому третьому шарі, а у атома натрію - теж вісім електронів на другому шарі, який тепер став зовнішнім:
Cl - 1s 2 2s 2 2p 6 3s 2 3p 6 - вісім електронів на зовнішньому рівні
Освіта іонної зв'язку
При цьому ядро атома натрію як і раніше містить 11 протонів, але загальне число електронів зменшилася до 10. Це означає, що число позитивно заряджених частинок на одну перевищує число негативно заряджених, тому загальний заряд "атома" натрію дорівнює +1.
"Атом" хлору тепер містить 17 протонів і 18 електронів і його заряд дорівнює -1.
Заряджені атоми, що утворилися в результаті втрати або придбання одне або декількох електронів, називаються іонами. Позитивно заряджені іони отримали назву катіонів. а негативно заряджені називаються аніонами.
Катіони і аніони, маючи протилежні заряди, притягуються один до одного електростатичними силами. Це тяжіння протилежно заряджених іонів і називається іонним зв'язком. Вона виникає в сполуках, утворених металом і одним або більше неметаллами. Перелічені нижче сполуки задовольняють цьому критерію і мають іонну природу: MgCl2. Fel2, CuF, Na2 0, Na2 S04. Zn (C2 H3 02) 2.
Є й інший спосіб зображення іонних з'єднань:
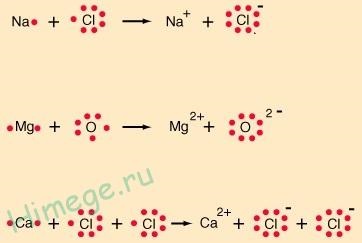
У цих формулах точками показують тільки електрони, що знаходяться на зовнішніх оболонках (валентні електрони). Такі формули називають формулами Льюїса в честь аме-риканського хіміка Г. Н. Льюїса, одного з основоположників (поряд з Л. Полингом) теорії хімічного зв'язку.
Перенесення електронів від атома металу до атома неметалла і освітньої-ня іонів можливими завдяки тому, що неметали мають високу електронегативність, а метали - низьку.
Через сильний тяжіння іонів один до одного іонні з'єднання в більшості своїй тверді і мають досить високу температуру плавлення.
Іонна зв'язок утворюється при перенесенні електронів від атома ме-Таллах до атому неметалла. Утворилися при цьому іони притому-ГІВА один до одного електростатичними силами.