Функціями стану називаються складні фізичні величини, що не піддаються безпосередньому виміру і обчислювані через пара-метри стану. У технічній термодинаміці використовуються наступні функції стану: внутрішня енергія, ентальпія, ентропія.
Параметри і функції стану газів завжди мають одне і те ж значення в даному стані незалежно від того, чи досягнута воно в процесі охолодження або нагрівання, розширення або стиснення газу.
Внутрішньої енергіейU називається запас енергії, яким обладаеттело в стані рівноваги. У процесах, що вивчаються технічної термо-динамікою, зміна внутрішньої енергії відбувається за рахунок зміни запасу внутрішньої теплової енергії тіла, яка є сумою кінетичної енергії поступального, обертального і колеба-ного руху молекул речовини і потенційної енергії їх взаємодії-дії. Внутрішня кінетична енергія залежить від температури тіла і збільшується при її підвищенні. Внутрішня потенційна енергія залежить від відстані між молекулами і збільшується при їх зближені-ванні, т. Е. Вона залежить від тиску і щільності. Таким чином, внутрішня енергія є функцією параметрів, що визначають стан тіла. У разі ідеальних газів, в яких відсутні сили взаємодії молекул, зміна внутрішньої енергії буде обумовлено тільки изме-ням кінетичної енергії руху молекул, т. Е. Для ідеального газу
Ентальпія. Макроскопічні тіла, властивості і поведінку которихізучается термодинаміки, знаходяться у взаємодії з оточуючими їх тілами. Сукупність внутрішньої енергії тіла і енергії зовнішньої взаємодії тіла з навколишнім середовищем об'єднується поняттям «ен-
У математичної записи ентальпія визначається виразом
де U - внутрішня енергія системи; Рv - потенційна енергія тиску-ня середовища на систему, виражена в параметрах системи.
З рівняння стану ідеального газу (2.5) твір Рv можна
замінити на RТ. і тоді
Ентальпія ідеального газу залежить тільки від його температури, т. Е.
Внутрішня енергія і ентальпія, віднесені до одиниці маси віщо-ства, називаються питомими (u і i), одиницею виміру яких служить Дж / кг.21
Ентропія є ознакою обміну енергією у формі теплоти.Із-сування величини ентропії характеризує наявність теплообміну між системою і навколишнім середовищем. При підведенні теплоти до тіла його ентропія зростає, при відведенні - зменшується. Ентропія ізольованої системи, що знаходиться в рівновазі, залишається незмінною.
Ентропія позначається через S і має розмірність Дж / К; питома ентропія - через s. її розмірність Дж / (кг · К).
Функції стану u. i. s є позитивними величинами. У досліджуваних технічної термодинаміки процесах зазвичай не потрібно визначення їх абсолютних значень, а досить визначити тільки зміна цих величин. Тому за початок відліку для u. i. s можна при-няти будь довільне стан системи. У термодинаміки умовно прийнято, що значення внутрішньої енергії, ентальпії і ентропії при нормальних фізичних умовах дорівнюють нулю.
Робота, що здійснюється при зміні стану газу, обчислюється заформулою
де р - тиск газу, що характеризує силу впливу газу на окру-колишнього середовища, Па; V - зміна обсягу газу, що характеризує меха-ническое переміщення кордонів тіла, м 3.
Тиск в термодинамічній системі є причина здійснення ра-боти. Розширення або стиснення газу можливо тільки тоді, коли тиск системи відрізняється від тиску навколишнього середовища. Ознакою соверше-ня роботи служить зміна обсягу системи. Робота позитивна, якщо газ розширюється, і негативна, якщо газ стискається.
Для графічного зображення роботи застосовується діаграма, називаються ваемая робочої, де кількість роботи вимірюється площею, розташованої над кривою зміни обсягу робочого тіла в процесі (рис. 2.1).
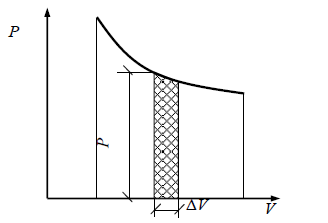
Мал. 2.1. Графічне зображення роботи газу (робоча діаграма)
Теплота. Кількість теплоти, якої система обмінюється з окру-лишнього середовищем при зміні її стану, визначається з виразу
де Т - температура; S - зміна ентропії системи.
Температура в процесах, що супроводжуються теплообміном, являє-ся причиною обміну енергією у формі теплоти. Обмін теплотою між ті-лами можливий тільки при наявності різниці температур.
Ознакою теплообміну є зміна ентропії. Збільшення ентропії свідчить про підводі теплоти до системи (теплота поклади-тельна), зменшення - про відвід теплоти з системи (теплота негативні-тельна), сталість ентропії - про відсутність теплообміну.
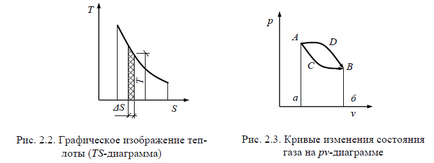
Для графічного зображення кількості теплоти застосовується діа-грами, звана теплової, де кількість теплоти вимірюється площа-дью під кривою зміни ентропії при зміні стану тіла (рис. 2.2). Робота і теплота, віднесені до 1 кг газу, позначаються малими-ми символами відповідно l і q і вимірюються в Дж / кг.
Стан системи в pv - і TS -діаграммах зображується точкою, а процес - кривий переходу її з початкового стану в кінцеве.
На рис. 2.3 переходи системи зі стану А в стан В здійснюва-ляють різними шляхами: по кривій А d і АСВ. Площі під цими кривими різні, отже, різні і кількості роботи і теп-лоти. У той же час початковий і кінцевий стани системи в обох процесах однаково (точки А і В).
Таким чином, робота і теплота проявляються лише в процесі через трансформаційних змін стану і залежать від характеру процесу.
В термодинамічній системі основну роль відіграє зміна внут-ренней енергії, що виражається в кількості роботи і теплоти, якими вона обмінюється з навколишнім середовищем. При цьому система збільшує свою внутрішню енергію, якщо теплота підводиться до неї (або над нею відбувається робота) і зменшує свою внутрішню енергію, якщо вона від-дає теплоту в навколишнє середовище (або вона робить роботу над окру-лишнього середовищем).
т. е. зміна внутрішньої енергії системи дорівнює різниці між коли-кість теплоти і роботи, якими система обмінюється з навколишнім середовищем.
Іншими словами, вся підведена до робочого тіла теплота расхо-
дметься на зміну внутрішньої енергії і на здійснення роботи через трансформаційних змін обсягу: