При певних умовах дві різні фази одного речовини (наприклад, рідина і газ) можуть співіснувати один з одним як завгодно довгий час. Для цього необхідно виконання наступних умов на кордоні двох фаз:
Вивести умови рівноваги з якихось принципів, розподілів!
Перша умова необхідно для теплового рівноваги, друге для механічного рівноваги, а третє для рівноваги за числами частинок. При невиконанні хоча б одного з цих умов між фазами буде існувати або потік тепла, або на кордон розділу фаз буде діяти сила, або частки будуть переходити з однієї фази в іншу.
Хімічний потенціал пов'язаний з енергією Гіббса співвідношенням
Для газу Ван-дер-Ваальса можна провести лінію, яка буде відповідати рівноваги фаз. Ця лінія називається бінодаль. Положення бінодалі визначається рівністю площ, що відсікаються горизонтальною лінією від залежності p (V).
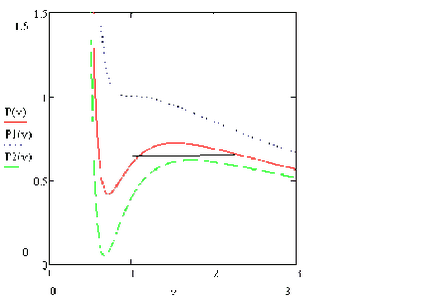
Лінія, відповідна точкам екстремуму для різних ізотерм, називається спінодаль.
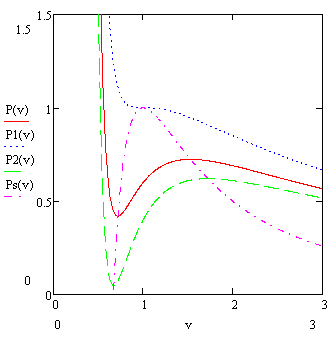
Можна показати, що спінодаль знаходиться завжди всередині бінодалі. Так само як і спінодаль, бінодаль завжди має максимум в критичній точці. Усередині спінодалі однофазное стан знаходитися не може з огляду на його нестійкості - там завжди знаходиться двофазне стан. Між спінодаль знаходиться область метастабільних станів. Тобто станів, існуючих кінцеве час, але через випадкових флуктуацій переходять з часом в двофазне стан. За бінодалью знаходиться область однофазних станів, коли існування двухфазного стану неможливо.
Якщо ізотермічні стискати газ Ван-дер-Ваальса, починаючи з великих обсягів, то буде відбуватися наступне. Спочатку в обсязі буде газ (пар), потім буде виникати крапля рідини, потім рідини буде все більше, поки вона не займе весь обсяг. Потім буде тільки рідина, яка практично нестислива. Перехід від рідкого стану в тверде, або з газоподібного в рідкий називається фазовим переходом першого роду. При цьому питома ентропія речовини і його питома обсяг відчувають стрибок. При фазових переходах другого роду ці величини відчувають злам.
Однак можливий і інший сценарій, пов'язаний з існуванням метастабільних фаз. В цьому випадку, якщо в системі немає збурень, і речовина практично не має домішок, при ізотермічному стисканні газу перехід його в рідкий стан почнеться не на бінодалі, а при меншому обсязі. Такий стан пара називається «пересиченим». У свою чергу, при розширенні рідини після бінодалі буде існувати «перегріта рідина». Обидва ці стани є метастабільними в тому сенсі, що вони стійкі по відношенню з малих збурень, але нестійкі по відношенню до кінцевих збурень. Але оскільки обурення носять найчастіше випадковий характер, кінцеве обурення рано чи пізно настає. В цьому випадку метастабільний стан розпадається з утворенням стабільної фази. Наприклад, при нагріванні води її кипіння може розпочатися не при 100 0 С, а при дещо більшою температурі.
Основними видами метастабільних станів є перегрів і переохолодження.
Переохолодження - охолодження речовини нижче температури рівноважного переходу в інший агрегатний стан (фазу); окремий випадок переведення системи в метастабільний стан. У послідовності фазових переходів від високотемпературних до низькотемпературних фаз (пар рідина кристал I кристал II) можливе переохолодження кожної фази по відношенню до наступної. Переохолодження необхідно, щоб фазовий перехід 1-го роду походив з кінцевою швидкістю. Велике переохолодження однорідної системи може бути обумовлено відсутністю зародків конкуруючої фази або дуже повільним їх зростанням внаслідок малої рухливості молекул.
Для металевих крапель спостерігалися наступні переохолодження де - рівноважна температура кристалізації: 52 К (Hg), 122 K (Sn), 296K (Ge), 277K (Cu). В атмосфері вода так само може перебувати в переохолодженому стані. Наприклад, маленькі краплі води можуть перебувати в атмосфері в рідкому стані до -40 о С.
Перегрів - нагрівання конденсованої фази до температури, що перевищує температуру рівноваги з іншого фазою, так що вихідна фаза виявляється в метастабільних станів. Граничний перегрів відповідає спінодалі. Рідини вдається перегріти значно вище температури рівноваги з паром. Перегріву можна досягти не тільки підвищенням. але і зменшенням зовнішнього тиску нижче.
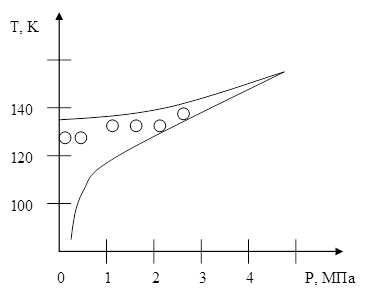
На малюнку 5 кружками відзначені експериментальні значення для гомогенного закипання аргону при ізобаріческом нагріванні в скляній трубці: нижня крива - лінія насичення (бінодаль), верхня крива - спінодаль.