1. Освіта солей
Органічні кислоти утворюють солі з металами, їх оксидами, карбонатами, гідрокарбонатами і лугами, наприклад:
CH3COOH + NaOH ® CH3COONa + H2O
2. Освіта галогенангидридов
Під дією галогенідів фосфору карбонові кислоти утворюють ангідриди (гідроксил заміщується на галоген):
CH3COOH + PCl5 ® CH3COCl + POCl3 + HCl
Хлорангидріди можуть також бути отримані дією на карбонові кислоти тіонілхлориду:
CH3COOH + SOCl2 ® CH3COCl + SO2 + HCl
Карбонові кислоти можна відновити тільки за допомогою дуже сильних відновників, тому в якості продуктів реакції завжди утворюються первинні спирти (а не альдегіди):
CH3COOH + LiAlH4 ® CH3CH2OH
Карбонові кислоти дуже легко втрачають діоксид вуглецю. Як правило, при цьому утворюється вуглеводень. Аліфатичні карбонові кислоти декарбоксилируется в присутності різних каталізаторів, що містять мідь. CH3CH2COOH ® CH3CH3 + CO2.
До реакцій декарбоксилювання відноситься і синтез Кольбе (див. Лекцію №2).
У присутності сильної кислоти (наприклад, сірчаної) карбонові кислоти дають зі спиртами складні ефіри:
CH3COOH + CH3CH2OH «CH3COOCH2CH3 + H2O
В результаті реакції утворюється рівноважна суміш. Щоб змістити рівновагу в бік утворення продукту, використовують великий надлишок спирту або видаляють воду в міру її утворення.
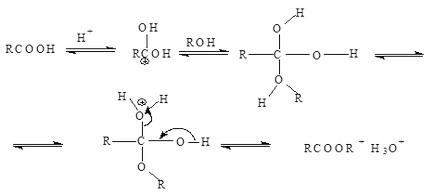
Механізм етерифікації є реакцією приєднання - відщеплення (нуклеофільне ацильного заміщення) Протон, що є каталізатором, полегшує атаку карбонільної групи нуклеофілом:
Мурашина кислота. Отримують з її натрієвої солі (форміату), яка утворюється при пропущенні оксиду вуглецю через 25-30% розчин лугу:
NaOH + CO ® HCOONa
Суспензію форміату натрію потім розкладають мурашиної кислотою.
Мурашина кислота застосовується для приготування каталізаторів, в медицині і в ряді синтезів. З її похідних найбільше значення має N, N-диметилформамід HCON (CH3) 2. Він є селективним розчинником при виділенні ацетилену з газових сумішей і при абсорбції HCl, SO2, CO2 і деяких інших газів.
Мурашина кислота володіє багатьма хімічними властивостями кислот, але їй притаманні і деякі специфічні особливості:
1. є хорошим відновником (легко окислюється):
HCOOH + HgCl2 ® Hg + CO2 + 2 HCl
Відновлювальні властивості мурашиної кислоти пояснюються тим, що вона в один і той же час є кислотою і оксіальдегідом, що видно з її формули.
2. при нагріванні з концентрованою H2SO4 розпадається з утворенням води і СО:
3. солі лужних металів при сплаву розпадаються з утворенням солей щавлевої кислоти (оксалати):
2 HCOONa ® H2 + NaOOC-COONa
Оцтова кислота. Широко застосовується для отримання складних ефірів, оцтового ангідриду, вінілацетату, а також у виробництві барвників, лікарських і запашних речовин. Велике практичне значення мають і солі оцтової кислоти - натрію, алюмінію, хрому, заліза, міді, свинцю і ін. В промисловості оцтова кислота виходить поруч способів:
1. окислення алканів;
2. окислення етанолу;
3. гідратація ацетилену і окислення одержуваного ацетальдегіду;
4. уксуснокислое бродіння сахарсодержащих розчинів.