Електроліт. Свинцеві акумулятори заливають електролітом, який складається з акумуляторної сірчаної кислоти і дистильованої води. Акумуляторна сірчана кислота - важка прозора масляниста рідина, добре розчиняється у воді, без запаху, роз'їдає шкіру, папір, матерію. Для приготування електроліту застосовують три сорти сірчаної кислоти: з державним Знаком якості, 1-го сорту і 2-го сорту. У сірчаної кислоти 1-го і 2-го сорту до допустимих меж знижено кількість домішок (заліза, оксидів азоту, миш'яку, марганцю та ін.). Акумуляторна сірчана кислота надходить з заводів в скляних бутлях зі скляними притертими пробками, нагвинчують поліетиленовими або пластмасовими кришками. Бутлі встановлюють у вербові кошики, поліетиленові або дерев'яні риштування. Їх повинні переносити два працівники при строгому дотриманні правил техніки безпеки.
Дистильована вода відрізняється від водопровідної або річковий майже повною відсутністю домішок (солей, сульфатів, хлоридів та ін). Таку воду отримують за допомогою перегінних кубів - дистиляторів.
Електроліт готують в чистій кислотостойкой посуді (ебонітовою, керамічної, фаянсової). Часто використовують дерев'яні баки, всередині викладені листовим свинцем. Не можна користуватися скляним посудом: при розчиненні сірчаної кислоти виділяється велика кількість тепла і скляні посудини, нагріваючись, можуть лопнути.
У посудину наливають дистильовану воду, а потім тонким струменем сірчану кислоту, перемішуючи цей розчин паличкою зі скла або ебоніту Так як сірчана кислота важча за воду, то виділяється при розчиненні тепло рівномірно розподіляється по всьому об'єму електроліту. Забороняється вливати воду в кислоту. В цьому випадку струмінь води, стикаючись тільки з поверхневими шарами кислоти, швидко нагрівається і розбризкується разом з частинками сірчаної кислоти Ці бризки, потрапляючи на шкіру, можуть заподіяти серйозні опіки. При приготуванні електроліту необхідно надівати захисні окуляри, гумові рукавички і фартух, суконний комбінезон і калоші. Для нейтралізації сірчаної кислоти і електроліту, що потрапили на шкіру або одяг, необхідно завжди мати 5-10% -ний розчин соди або 5-10% -ний розчин нашатирного спирту. Якщо сірчана кислота потрапила на шкіру, то її слід відразу змочити захисним розчином, а потім кілька разів промити водою. Щільність електроліту вимірюють ареометром (рис 211, а) Він являє собою скляну трубку 4, запаяну з обох сторін, в нижній частині якої знаходиться вантаж, а у верхній - шкала Ареометр Л, опущений в мензурку 1 з електролітом 2, займає вертикальне положення, причому деяка частина його виступає назовні Глибина занурення ареометра залежить від щільності електроліту:
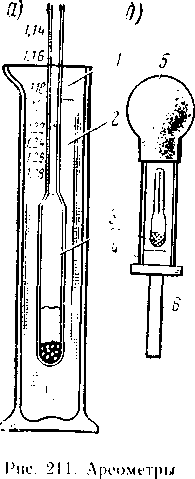
чим більше щільність електроліту, тим менше занурюється ареометр За поділу шкали, яке знаходиться на рівні розчину, визначають щільність електроліту Акумуляторний ареометр (рис 211, б) поміщається в скляну трубку 4, на один кінець якої надіта гумова груша 5, а на інший -трубчаста наконечник 6 з кислотостойкого матеріалу за допомогою гумової груші електроліт всмоктують в скляну трубку з ареометром. Для заповнення нових стаціонарних свинцевих акумуляторів застосовують електроліт щільністю 1,18 г см 3 при температурі 25 ° С З підвищенням щільності електроліту від 1,18 до 1,29 гем 3 знижується температура його замерзання Наприклад, електроліт щільністю 1,29 г / см 3 замерзає при температурі -74 С Тому переносні акумулятори, що працюють при низьких температурах, заливають електролітом підвищеної щільності Наприклад, в центральних районах при температурі взимку до -ЗО З в стартерні акумулятори заливають електроліт щільністю 1,27 г / см 3 Акумулятори нібито АБН-72 і АБН-80 заливають електролітом щільністю 1,21 г їм 3 Перед заливанням в акумулятори електроліт необхідний /) охолодити до температури 25 С Для того щоб зменшити час охолодження, рекомендується ступеневу приготування електроліту: з кислоти щільністю 1,83 г їм 3 приготувати електроліт щільністю 1,4 гем 3. а з, нього - - електроліт щільністю 1,18-1,3 г см 3
Хімічні процеси. У зарядженого свинцевого акумулятора активна маса позитивних пластин складається з двоокису свинцю РЬ02. а негативних - з губчатого свинцю РЬ Двоокис свинцю має темно-коричневий колір, а губчастий свинець - світло-сірий Пластини занурені в електроліт - водний розчин сірчаної кислоти У результаті електролітичноїдисоціації молекули сірчаної кислоти електроліту розпадаються на позитивні іони водню і негативні іони кислотного залишку
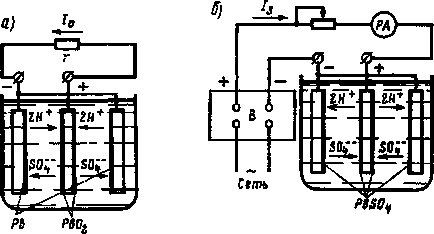
До зарядженого акумулятора приєднаємо приймач енергії опором г (рис 212, а) і розглянемо хімічні процеси в акумуляторі при його розряді Разрядний ток 1. спрямований від позитивної пластини через приймач енергії г до негативних пластин, а потім через електроліт - від негативних пластин до позитивної
У електроліті позитивні іони водню 2Н + переміщаються у напрямку струму, а негативні іони БОГ - - проти У результаті розряду в свинцевому акумуляторі відбуваються хімічні реакції
З рівняння видно, що в процесі розряду двоокис з віце РЬО. на позитивних пластинах і губчастий свинець РЬ на негативних пластинах перетворюються в сірчанокислий свинець РЬЯО + Ці хімічні реакції йдуть з поглинанням сірчаної кислоти, тому в про процесі розряду щільність електроліту знижується. При глибокому розряді сірчанокислий свинець перетворюється в тверду крупнокристалічного сіль, яка погано відновлюється під час заряду. Тому акумулятори розряджають тільки до певної щільності електроліту. Для стаціонарних акумуляторів вона дорівнює 1,17- 1,15 г / см 3. Для заряду через акумулятори пропускають постійний струм, спрямований протилежно разрядному току. Для цього акумулятор підключають до випрямляча В (рис. 212, б) або іншого джерела постійного струму. Позитивний затиск випрямляча з'єднують з блоком позитивних пластин, а негативний - з блоком негативних пластин.
Зарядний струм 13 направлений всередині електроліту від позитивних пластин до негативних. Тому до позитивних пластин підходять негативні іони кислотного залишку. а до негативних пластин - позитивні іони водню 2Н +.
Хімічні реакції при заряді можна представити таким рівнянням: Р1ебЬ4 + РЬ5Ю4 + 2Н2 0 РЬ (02 + 4 2Н2 804.
Під час заряду сірчанокислий свинець РЬБ04 перетворюється на двоокис свинцю РЬ02 на позитивних пластинах і в губчастий свинець РЬ на негативних пластинах. Одночасно збільшується кількість сірчаної кислоти в розчині, що підвищує щільність електроліту до тих пір, поки весь сульфат свинцю не перетвориться в активні речовини, які були в акумуляторі перед розрядом. Тому щільність електроліту в кінці заряду дорівнює щільності електроліту на початку розряду. У стаціонарних акумуляторів щільність електроліту в кінці заряду досягає 1,2-1,21 г / см 3; у акумуляторів типу АБН щільність електроліту досягає 1,18-1,2 г / см 3 влітку і 1,3-1,32 г / см 3 взимку. Після відновлення активних мас на пластинах зарядний струм розкладає воду електроліту на водень і кисень, які, змішуючись, утворюють вибухонебезпечну суміш,
звану гримучим газом. Розпад води електричним струмом виявляється по інтенсивному виділенню бульбашок водню і кисню на поверхні електроліту ( «кипіння»).