ДІФФУЗІOННО-КОНТРОЛЮЮТЬСЯ РЕАКЦІЇ. р-ції, швидкість до яких визначається дифузійним зближенням реагують частинок, після чого їх взаємодій. відбувається практично миттєво. До диффузионно-контрольованим реакцій відносяться: бімолекулярного рекомбінація атомів і іонів в розчинах, рекомбінація і диспропорционирование радикалів та іон-радикалів. р-ції молекул зі своб. атомами або радикалами в твердому тілі і ін. Кінетика диффузионно-контрольованих реакцій описується теорією, заснованої на припущенні про можливість застосування до поступат. самодиффузии молекул макроскопіч. законів дифузії Фіка; про вплив дифузійного масопереносу на кінетику хім. р-ций см. в ст. Макрокінетика. Теорію диффузионно-контрольованих реакцій застосовують для пояснення мн. процесів, пов'язаних з дифузією мікрочастинок: зростання колоїдних частинок, електроосадження. гасіння люмінесценції. дифузійного горіння (роль диффундирующих частинок грає окислювач. поширюється в середовищі - краплі пального) і ін. кинетич. особливості диффузионно-контрольованих реакцій наочно ілюструються на прикладі молекулярних процесів типу:
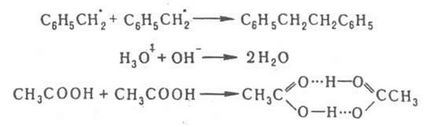
Як правило, такі р-ції екзотермічни і мають малу енергію активації ([10 кДж / моль). Якщо вони протікають у газовій фазі, їх швидкість визначають ймовірністю зіткнень частинок або газокінетіч. перетином (див. напр. Іони в газах). У конденсується. фазі, напр. в розчині, що реагують частки А і В, стикаючись з молекулами р-розчинника, безладно переміщаються до тих пір, поки не відбудеться їх зустріч в одній структурної осередку рідини. Таку зустріч можна розглядати як утворення дифузійної пари [А. В] в результаті взаємної поступат. самодиффузии частинок. Р-ція відбувається в дві последоват. стадії продукти, де кD і к'D - константи швидкості утворення і розпаду дифузійної пари соотв. а кС характеризує швидкість перетворення дифузійної пари в продукти р-ції. Видимий на досвіді константа швидкості р-ції Кнабл = КC кD (к'D + кС) - 1. При виконанні умови к'D >> кС бімолекулярного р-ція протікає в кинетич. режимі і Кнабл = КC = KАВ. де КАВ = кD / к'D; при КC> кD процес лімітується дифузією і Кнабл = кD. Вперше проблема опису дифузійно-контрольованих реакцій була проаналізована М. Смолуховським в застосуванні до коагуляції колоїдів. У квазістаціонарному режимі швидкість зустрічі частинок А і В: v = 4. 10 - 3 p DrNA [A] [B] мол' / (л. С), де D-сума коеф. дифузії частинок А і В (див 2 / с), r - сума їх радіусів (см), NA - постійна Авогадро. Частинки при цьому розглядаються як сфери, а рідина. в якій вони дифундують, - як ізотропна середу. Квазістаціонарний режим р-ції встановлюється за час t
r 2 / D (в низьков'язких рідинах t
10 - 8 - 10 - 10 с). Якщо між частинками діють сили тяжіння або відштовхування (іони або молекули. Володіють дипольним моментом), то замість R використовують т. Зв. ефективний радіус зустрічі (Reff):
де U - потенціал міжмолекулярних взаємодій. k - постійна Больцмана. Т - абс. т-ра. Коеф. дифузії пов'язаний з в'язкістю р-розчинника h. Відповідно до закону Стокса - Ейнштейна, для сферич. частинки радіуса r в ізотропному середовищі D = 10 6 kT / 6 p r h і для двох однакових частинок кD = 2,7. 10 3 NA kT / h (л / моль. С). Досвідчені дані зазвичай підтверджують передбачали цим співвідношенням залежність кD від Т / h. однак по абс. величиною досвідчені і розрахункові значення кD не завжди збігаються. Для кращого збігу вводять т. Зв. фактор мікротренія f, к-рий залежить від розмірів диффундирующих частинок і молекул р-розчинника, і використовують ф-лу Стокса - Ейнштейна у вигляді: D = 10 - 6 kT / 6 p r h f. Описана теорія дозволяє розраховувати константи швидкості рекомбінації радикалів, напр. деяких алкільних, алкоксильной і феноксіл'них радикалів в вуглеводневих р-телеглядачам, добре узгоджуються з експериментом. У разі взаємодій. частинок великого розміру з певним реакційним центром (атомом або атомної групою) на швидкість диффузионно-контрольованих реакцій істотно впливає взаємна орієнтація частинок в структурної осередку. Сприятлива для р-ції орієнтація частинок, так само як і їх зустріч, обумовлена взаємними поворотами при випадкових невпорядкованих зіткненнях і тому розглядається як результат вращат. і поступат. дифузії. Для р-ції багатоатомних частинок потрібно, як правило, їх певна взаємна орієнтація. В цьому випадку реагенти мають хім. анізотропією. к-раю характеризується стеріч. фактором Р [1. Дифузійно-контрольовані реакції хімічно анізотропних реагентів розглядають як контрольовану дифузією зустріч двох частинок - сфер з "чорними плямами", при якій відбувається контакт чорних плям. Константа швидкості такої р-ції кD = 4 p10 - 3 DNA Reff л / (моль. С), де Reff пов'язаний з сумою радіусів частинок r і стеріч. фактором Р співвідношенням: т. е. кD прямо пропорційна НЕ Р, як для р-ций в газовій фазі, а внаслідок повторних зустрічей частинок в клітці. к-які супроводжуються поворотом частинок, що призводить до усереднення Р. Д іффузіонно-контрольовані реакції вивчаються методами, розробленими для швидких р-ций, зокрема імпульсним фотоліз. імпульсним радіоліз. методом переривчастого освітлення. ЕПР і ін. Константи швидкості рекомбінації атомів і радикалів в розчинах мають значення близько 10 9 -10 8 л / (моль. С).
===
Ісп. література: Ентеліс С. Г. Тигер Р. П. Кінетика реакцій в рідкій фазі, М. 1973; Мелвін-Хьюз Е. А. Рівновага і кінетика реакцій в розчинах. пер. з англ. М. 1975; Овчинников А. А. Тімашов С. Ф. Білий А. А. Кінетика диффузионно-контрольованих хімічних процесів, М. 1986. Е. Т. Денисов.
