Всі тварини і рослинні тканини складаються з різних хімічних сполук: білків, вуглеводів, жирів і вітамінів. І хоча всі ці речовини необхідні для нормального розвитку організму, найбільше значення мають білки. Саме вони служать тієї основної матерією, з якої складаються всі частини окремої клітини і цілого організму. Білки є вищим ступенем розвитку матерії і з ними нерозривно пов'язані всі незліченно різноманітні прояви життя, починаючи з найпростіших функцій найпримітивніших істот і закінчуючи найскладнішими функціями людської діяльності.
Будова білка. Розрізняють білки прості і складні. Простий білок в даний час розглядається як продукт поліконденсації амінокислот, т. Е. Як природний полімер. Складні білки складаються з простого білка і небілкових компонентів - вуглеводів, ліпідів, нуклеїнових кислот та інших сполук.
Загальним для всіх білків є те, що їх макромолекули складаються з багатьох сотень ланок, з'єднаних між собою так званої пептидного зв'язком, що має будову
За своєю природою кожна ланка - залишок однієї з амінокислот. Вони утворюють поліпептидні ланцюги, з яких кожна містить десятки і навіть сотні залишків різних амінокислот. Всі інші амінокислоти, що входять до складу білка, відносяться до # 945; -аминокислотам, у яких аміногрупа NH2 пов'язана з тим же атомом вуглецю, з яким пов'язана і карбоксильная група СООН. Все a-амінокислоти (за винятком гетероциклічних) можуть бути виражені загальною фор-мулою
де R - вуглеводневий радикал.
Амінокислоти відрізняються один від одного не тільки величиною, а й числом що входять в них груп NH2 і СООН, а також наявністю в їх складі атомів інших елементів, таких, як S, Вг, I. В даний час відкрито близько 26 різних амінокислот, що входять в склад білків. Приблизно половина цієї кількості містить лише по одній групі NH2 і СООН; вони є простими, або моноаминокислотах. Інші містять дві групи СООН на одну аміногрупу і мають характерні кислими властивостями. Третя група амінокислот має явно вираженими основними властивостями, вона містить одну групу СООН на дві аміногрупи. Крім того, до складу білків входять кілька циклічних ами-нокіслот, більш складних по складу і структурі їх радикала R.
Вперше найбільш проста схема будови білка була дана Фішером (1906) у вигляді поліпептидного ланцюжка.
Реакції поліконденсації протікають по наступному рівнянню
Саме за допомогою поліпептидного зв'язку йде подальшу освіту полімерів білків будь-якої складності. У міру збільшення числа амінокислотних ланок в молекулах поліпептидів зростає і кількість можливих ізомерів. Так, англійський біохімік Річард Сінджа підрахував, що білок з молекулярною масою 3400 (порівняно коротколанцюговий), в кожній молекулі якого міститься 288 амінокислотних залишків, а до складу входить лише 12 амінокислот, може мати абсолютно астрономічне число ізомерів - 10 300. Якби можна було зібрати воєдино лише по одній молекулі кожного з можливих ізомерів цього гіпотетичного білка, то загальна маса цих молекул склала б 10 277 кг. По-кільки маса Землі обчислюється значно меншою ціфрой- 10 24 кг, - абсолютно очевидно, що реально в природі існує лише кілька ізомерів це-го білка.
Кількість білків, що зустрічаються в природі, надзвичайно велике. У настою-ний час в чистому вигляді виділено кілька сот різних білків. Причому дослідження показали, що загальне число білків, що відрізняються один від одного за своїми хімічними властивостями, в будь-якому живому організмі досягає декількох тисяч. Часто навіть зовні абсолютно ідентичні білки з різних джерел не завжди виявляються однаковими за складом і структурі. Отже, все різноманіття форм життя на нашій планеті обумовлено існуванням декількох мільйонів окремих білків, кожен з яких в своєму роді унікальний.
Білкова макромолекула представляє собою дуже складний комплекс. Повторюваними ланками його є так звані мікромолекули, до складу кожної з яких входить пептидная ланцюжок з 4-6 амінокислот і циклічне освіту (дікетопіперазіновое кільце).
Таким чином, білки за складом являють собою складні поліпептиди, а за будовою - високополімеров (високополіконденсати).
Як показали численні дослідження, не тільки амінокислоти мають в поліпептидного ланцюга кожна своє місце, але і самі ланцюга в білках розташовані в строго визначеному порядку. Досить порушити розташування ланцюгів в молекулі, як білок зміниться і загине. Поряд з пептидним зв'язком усередині білкової молекули є і інші види зв'язку, зокрема, воднева. В результаті цього макромолекула білка в своїй основі набуває характеру дуже міцного освіти.
Численними дослідженнями встановлено, що всі білки за формою їх макромолекул можуть бути поділені в основному на дві групи - фібрилярні і глобулярні.
Фібрилярні, або волокнисті, білки (від латинського слова fibrilla - волокно) складаються з макромолекул у вигляді тонких витягнутих ниток, зазвичай з'єднаних між собою. У цю групу входять білки, які є складовими частинами шкіри і сухожиль (колаген, желатин), волоса і роги (кератин), м'язів (міозину) і ін. В організмі вони виконують в основному механічні функції, хоча деякі з фібрилярних білків мають і біологічною активністю . Так, названий вище міозин є ферментом; він розщеплює аденазінтріфосфорную кислоту (АТФ), яка володіє великою кількістю енергії, що виділяється при її розщепленні.
Фібрилярні білки при кімнатній температурі зазвичай нерозчинні в по-де, однак здатні набухати в ній, що говорить про їх гідрофільних властивостях.
Глобулярні білки (від латинського слова globula - кулька) складаються з макромолекул кулястої, еліпсовою, рідше веретеноподібної форми. Характерною особливістю цих білків є хороша розчинність в воді, т. Е. Висока гідрофільність. Глобулярні білки знаходяться переважно в біологічних рідинах: в крові, лімфі, протоплазмі клітин. Білки цієї групи - альбуміни, а також глобуліни яєчного білка, молока, сироватки крові, пепсин шлункового соку і інші - виконують в організмі дуже важливі біологічні функції.
Численні експерименти показали, що характер зв'язків в фібрилярних і глобулярних білках однаковий. Молекулярна маса обох основних структурних видів білка також приблизно однакова (від 30 000 до 1 000 000 і більше), але форма значно відрізняється. Так, у фібрилярних білків довжина макроглобул в сотні і тисячі разів перевищує їх товщину. Наприклад, макроглобула проколлагена з молекулярної масою 680 000 має довжину близько 30 нм, а товщину - всього лише кілька десятків нанометрів.
білкових глобул. Для стійкості колоїдних частинок має значення тільки вода, що створює зовнішню водну оболонку. Саме вона і перешкоджає зіткненню і об'єднанню білкових макромолекул.
Складні білки складаються з макроглобули простого білка, до якої приєднані інші компоненти: вуглеводи або ліпіди, фосфорна кислота і т. П. До цієї групи належать також і нуклеопротеїни, будова яких особливо інтенсивно вивчається останнім часом. Нагадаємо, що нуклеопротеїни складаються з білка і так званої нуклеїнової кислоти, яка представляє собою полімер, що складається з мононуклеотидів (мономерів), з'єднаних між собою складноефірний зв'язку. Кожен з мономерів є одним з пуринових (аденін або гуанін) або піримідинових (тимін, цитозин або урацил) підстав, з'єднаних через рибозу або дізоксірібозу з фосфорною кислотою. Особливе зна-чення надають в біологічних Електричний заряд білків, крім їх своєрідного будови, є особливістю їх властивостей. У білковій молекулі містяться дві полярні групи: основна - NH2 і кислотна - СООН, які і повідомляють макромолекулі амфотерні властивості. Білки не просто електроліти, а електроліти - амфоліти. Це означає, що у водних розчинах макромолекули здатні диссоциировать як кислоти, т. Е. З відщепленням іонів водню
і як підстави, т. е. з відщепленням іонів гідроксилу
Макромолекули білків мають спиралевидную конфігурацію, яка може змінюватися в залежності від знака їх заряду. Так, в нейтральному стані білка протилежно заряджені іони NH3 + і СОО - відчувають сильне тяжіння один до одного і тим самим викликають укорочення білкової нитки і навіть скручування її у вигляді спіралі:
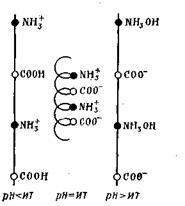
У кислому і лужному середовищі відбувається відштовхування окремих груп і розтягування ланцюга в цілому, т. Е. Розкручування спіралі.
Таким чином, заряд білка залежить від співвідношення в його молекулах карбо-ксільних і амінних груп і від рН середовища. Значення рН розчину білка, при якому білок стає електронейтральний, називається ізоелектричної точкою даного білка. Кожен білок має своє значення рН, при якому він зна-диться в ізоелектричному стані (табл.6.5).
Таблиця 6.5 Досвід показує, що в ізоелектричному стані в'язкість білків найменша. Це пов'язано зі зміною форми макромолекул, так як макромолекули в розгорнутому стані надають розчинів більш високу в'язкість, ніж макромолекули, згорнуті в спіраль або клубок.
Експериментальне визначення ізоелектричної точки білкових розчинів, як і визначення ізоелектричного стану ліофобних золів, може бути вироблено прямим або непрямим методами.
Прямі методи зводяться до спостереження за поведінкою частинок в електричному полі при електрофорезі. При цьому досліджуваний білок піддають електрофорезу в буферних розчинах з різними значеннями рН. У буферному розчині зі значенням рН, рівним ізоелектричної точці білка, останній електронейтрален і не переміщається в електричному полі. Ці спостереження проводять або макроскопічно в особливих електрофоретичних апаратах, або мікроскопічно в кюветі ультрамікроскопа. Крім прямих методів спостереження ізоелектричного стану білків існують і непрямі методи, які зводяться до спостереження максимуму або мінімуму того чи іншого фізичного властивості, змінюється зі зміною дзета-потенціалу випробуваного розчину. Всі ці методи детально описані у відповідних інструкціях.