Загальна характеристика азоту
Азот - сьомий елемент Періодичної таблиці. Позначення - N від латинського «nitrogenium». Розташований у другому періоді, VА групі. Відноситься до неметалів. Заряд ядра дорівнює 7.
Велика частина азоту знаходиться у вільному стані. Вільний азот є головною складовою частиною повітря, який містить 78,2% (об.) Азоту. Неорганічні сполуки азоту не зустрічаються в природі у великих кількостях, якщо не брати до уваги натрієву селітру NaNO3. утворить потужні пласти на узбережжі Тихого океану в Чилі. Грунт містить незначні кількості азоту, переважно у вигляді солей азотної кислоти. Але у вигляді складних органічних сполук - білків - азот входить до складу всіх живих організмів.
У вигляді простого речовини азот - це безбарвний газ, який не має запаху і дуже мало розчинний у воді. Він трохи легший за повітря: маса 1 л азоту дорівнює 1,25 г.
Атомна і молекулярна маса азоту
Відносною атомною масою елемента називають відношення маси атома даного елемента до 1/12 маси атома вуглецю. Відносна атомна маса безрозмірна і позначається Ar (індекс «r» - початкова буква англійського слова relative, що в перекладі означає «відносний»). Відносна атомна маса атомарного азоту дорівнює 14,0064 а.е.м.
Маси молекул, також як маси атомів виражаються в атомних одиницях маси. Молекулярною масою речовини називається маса молекули, виражена в атомних одиницях маси. Відносної молекулярної масою речовини називають відношення маси молекули даної речовини до 1/12 маси атома вуглецю, маса якого дорівнює 12 а.е.м. Відомо, що молекула азоту двоатомний - N2. Відносна молекулярна маса молекули азоту буде дорівнює:
ізотопи азоту
У природі азот існує у вигляді двох стабільних ізотопів 14 N (99,635%) і 15 N (0,365%). Їх масові числа рівні 14 і 15 відповідно. Ядро атома ізотопу азоту 14 N містить сім протонів і сім нейтронів, а ізотопу 15 N - така ж кількість протонів і шість нейтронів.
Існує чотирнадцять штучних ізотопів азоту з масовими числами від 10-ти до 13-ти і від 16-ти до 25-ти, з яких найбільш стабільним є ізотоп 13 Nс періодом напіврозпаду рівним 10 хвилин.
Іони азоту
На зовнішньому енергетичному рівні атома азоту є п'ять електронів, які є валентними:
Схема будови атома азоту представлена нижче:
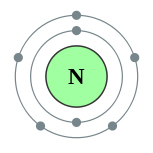
В результаті хімічної взаємодії азот може втрачати свої валентні електрони, тобто бути їх донором, і перетворюватися в позитивно заряджені іони або приймати електрони іншого атома, тобто бути їх акцептором, і перетворюватися в негативно заряджені іони:
N 0 -5e → N 2 +;
N 0 -4e → N 4+;
N 0 -3e → N 3 +;
N 0 -2e → N 2 +;
N 0 -1e → N 1+;
N 0 + 1e → N 1;
N 0 + 2e → N 2;
N 0 + 3e → N 3.
Молекула і атом азоту
Молекула азоту складається з двох атомів - N2. Наведемо деякі властивості, що характеризують атом і молекулу азоту: