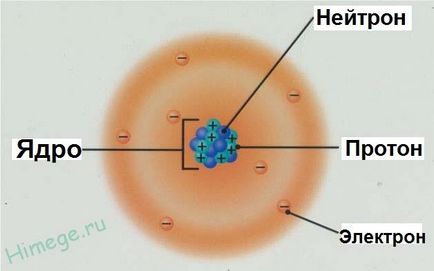
Модель атома азоту
Всі тіла навколишні нас, незважаючи на їх різноманітність, складаються з найдрібніших частинок - атомів, що складаються, в свою чергу, з ще менших частинок - протонів, нейтронів і електронів. Це стало відомо відносно недавно, атом довгий час вважався неподільною часткою, тобто найпростішої (див історію розвитку уявлень про атом).
В основі сучасної теорії будови атома лежать наступні основні положення:
- Атом складається з ядра та електронної оболонки
- Електронна оболонка - сукупність рухомих навколо ядра електронів
- Ядра атомів заряджені позитивно, вони складаються з протонів p і нейтронів n (разом звуться нуклони) .Заряд ядра дорівнює сумі протонів (позначені червоним кольором на малюнку).
- Атом в цілому електронейтрален, число електронів е-одно числу протонів p +. дорівнює порядковому номеру елемента в таблиці Менделєєва. Саме заряд ядра є основною характеристикою атома і визначає його положення в таблиці Менделєєва. Хіміческійелемент - сукупність атомів з однаковим зарядом ядра.
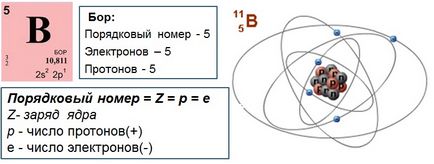
- Якщо атом приєднує або віддає електрони (що несуть негативний заряд) то його електронейтральність порушується, він перетворюється в негативно або позитивно заряджений іон відповідно.
При утворенні позитивно зарядженого іона кількість електронів зменшується (на величину заряду даного іона), а при утворенні негативно зарядженого іона кількість електронів збільшується (на величину заряду даного іона).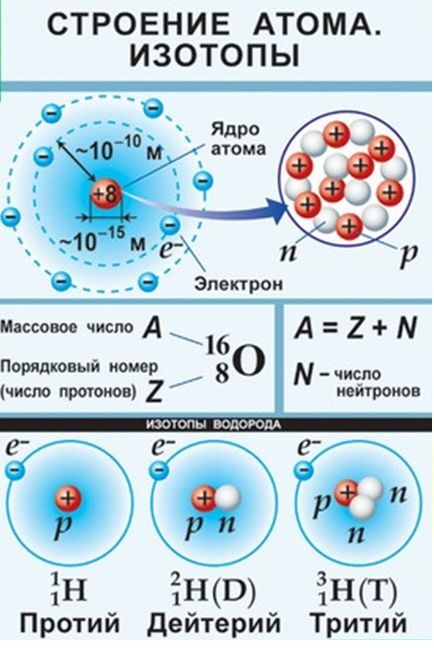
Е0 + ne - = Еn-
В атомах є невеликі важкі ядра, до складу яких входять протони і нейтрони і в яких зосереджена майже вся маса атома. Велика частина атома заповнена електронами і являє собою майже порожній простір.
У природі існують атоми одного елемента, тобто мають однаковий заряд ядра, але різні масові числа - ізотопи (від грец. Ισος - «рівний», «однаковий», і τόπος - «місце», займають одне і те ж "місце" в таблиці Менделєєва). У них число протонів однаково, але різне число нейтронів. У елемента водню існує три ізотопи: протий - з масовим числом 1, Дейтерій - з масовим числом 2 (D2O - важка вода), і радіоактивний тритій з масовим числом 3.
У таблиці Менделєєва приведена відносна атомна маса - середнє арифметичне мас ізотопів з урахуванням їх% змісту в земній корі.
Кількість нейтронів не вказується в таблиці, тому щоб розрахувати число нейтронів, потрібно з маси атома (вказується в завданні) відняти порядковий номер (число протонів).
У хімічних реакціях склад ядер атомів не змінюється (викл. Ядерні реакції - не розглядаються в даному курсі, область вивчення фізики), змінюватися може тільки склад електронної оболонки (кількість електронів). Тому нам важливо знати, яким чином розташовуються електрони в атомі, тобто будова електронних оболонок атомів.
Електрони розташовані в тривимірному просторі навколо ядра атома. Усередині цього про-простору є області, в яких можуть розташовуватися електрони. Ці області називаються орбиталями. Кожна орбіталь характеризується розміром, формою і орієнтацією всередині атома, і кожної присвоєно буквено-цифрове позначення.
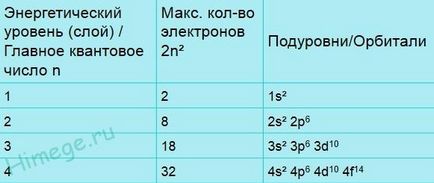
Хоча в атомі є велика кількість орбіталей, в звичайних умовах тільки порівняно мала їх частина зайнята електронами. Нижче призводить-ся список загальноприйнятих позначень перших (т. Е. Найближчих до ядра) вісімнадцяти орбіталей. Цифра (номер) характеризує розмір або середовищ-ний діаметр орбіталі, а буква - форму орбіталі. s-Орбиталь представ-ляет собою сферу, центр якої збігається з центром (ядром) атома, а три р-орбіталі нагадують об'ємні вісімки, осі яких перпендикулярні один одному. Таким чином, 1s-орбіталь - сферичні-кая і найменша за розмірами; 2s-орбіталь - також сферична, але біль-шого розміру; 2р-орбіталі мають форму вісімок і за розміром сопост-віми з 2s-орбиталью. d-Орбіталі мають більш складну форму.
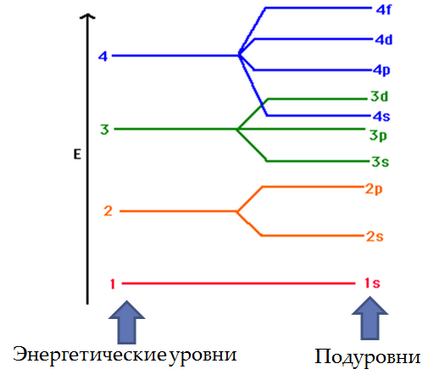

Орбіталі групуються відповідно до їх розмірами і ці групи називаються шарами або оболонками або енергетичними рівнями. У першій електронній оболонці є лише одна орбіталь - 1s. На другий оболонці їх вже чотири, а на третій - дев'ять. Кожна орбіталь може бути вільної (порожній) або зайнятої одним або двома електронами. Зауважимо, що в кожної обо-оболонка (крім першої) існує три р-орбіталі і п'ять d-орбіталей (у всіх оболонках, крім двох перших). Оскільки на кожній орбіта-ли може перебувати по 2 електрони, групу р-орбіталей можуть займати не більше 6 електронів, а групу d-oрбіталей - 10 електронів.
Нижче наведені електронна конфігурація атомів кисню і сірки.
