Тема уроку - "Склад атомних ядер. Ізотопи". Ми повторимо, що собою являє елементарна модель атома, її будова, схоже на нашу Сонячну систему. Дізнаємося, в якому році фізики дізналися на досвіді Резерфорда, з чого насправді складається атомне ядро, його щільність, як можна отримати новий елемент шляхом додавання до нього протона.
Тема: Періодичний закон і Періодична система хімічних елементів Д. І.Менделеева
1. Будова атома
Елементарний атом насправді виявився складною частинкою, який складається з ядра та електронної оболонки. За своєю будовою він схожий на сонячну систему. В нашій сонячній системі в центрі знаходиться масивна сонце, а в атомі - ядро. Навколо сонця обертаються планети, а в атомі - електрони. Цю модель атома створив в 1910 році Ернест Резерфорд. І тільки в 1932 році фізики дізналися, що ядро атома складається з елементарних частинок: протонів - позитивно заряджених і не мають заряду - нейтронів.
Атом по здогаду Резерфорда майже порожній простір з ядром посередині. Ядро - дуже щільне утворення, що складається з протонів і нейтронів. Щільність атомного ядра складає 100 000 тонн / мм3. Додаючи протон в ядро атома, кожен раз виходить новий елемент. Якщо в ядрі всього 1 протон, то це водень Н, якщо 2 - то це гелій Не, якщо 3 це літій Li. І так далі.
Кажуть, що протони надають атому індивідуальність. А ось нейтрони абсолютно не впливають на індивідуальність атома, а відображаються тільки на масі даного елемента.
2. Нукліди
Нукліди - це частинки, що мають певне масове число і час життя достатню для їх вивчення. Нукліди діляться на
- стабільні. Стабільні нукліди не піддавалося мимовільного радіоактивного розпаду.
- радіоактивні або радіонукліди. Радіонукліди можуть мимовільно розпадатися, утворюючи інші нукліди.
Радіонукліди діляться на
Довгоживучі радіонукліди виникли разом із Землею. Їх період напіврозпаду становить 5 ∙ 108лет.
Найбільшою кількістю радіонуклідів по 34 володіє платина Pt і осмій Os. Деякі елементи мають лише один стабільний нуклід. Наприклад, золото Au і кобальт Co. А максимальним числом стабільних нуклідів 10 володіє олово Sn. У багатьох елементів все нукліди - радіоактивні. Це все елементи, що мають атомний номер більше ніж у свинцю Pb, а також технеций Tc і прометий Pm. Загальна кількість всіх нуклідів всіх елементів перевищує 3100.
3. Подання про ізотопи
Кількість нейтронів в ядрі атома називається його ізотопічним числом і позначається N.
Якщо атом містить однакове число протонів. т. е. має однаковим зарядом, але різну кількість нейтронів. то він буде мати різну масу. Такі атоми називаються ізотопами.
N - ізотопічні число
А - масове число
Z - Зарядове число
При позначенні ізотопів поруч з символом хімічного елемента зліва вгорі пишеться масове число, а зліва внизу - Зарядове число. 612с. Іноді можна зустріти такий запис: вуглець -12.
Деякі ізотопи мають власну назву. Це характерно для ізотопів водню і радону. Ізотоп водню 1Н - проти, 2Н - дейтерій, 3Н - тритій.
Також можна зустріти ізотопи кисню 16О, 17О, 18О, які зустрічаються в природі.
Відносна атомна маса елемента

Мал. 1. Ізотопи хлору
Атом дуже малий і маса його повинна бути незначна. У 1961 році на міжнародному з'їзді теоретичної і прикладної хімії фізики і хіміки прийняли рішення, що масу атома вимірюватимуть не в кг або г, а в одиницях, які отримали назву атомна одиниця маси (а. Є.М.). Було прийнято, що ізотоп вуглецю -12, як найстабільніший в природі матиме масу 12 а. Є.М. Атомна одиниця маси за величиною дорівнює:
1 моль будь-якої речовини містить частинок, що дорівнює числу Авогадро.
4. Ізотопи хлору
Відносна атомна маса елемента, яка наводиться в періодичній системі - це середня величина масових чисел природних ізотопів з урахуванням їх процентного вмісту в природі.
Наприклад, всі атоми хлору представлені в природі ізотопами 35Cl (75%) і 37 Сl (25%). Рис.1.
Відносна атомна маса хлору буде обчислюватися по формулі = 35,5.
5. Ізотопи водню
Атом водню, що має один протон в ядрі і не має нейтронів, називається проти. «Протас» - це первинний. Так прийнято називати перший ізотоп водню.
Мал. 2. Ізотоп водню дейтерій
Якщо в атом водню крім протона входить ще і 1 нейтрон. то він буде називатися дейтерій.
Газ дейтерій, як і водень, має двоатомних молекул D2.
Цього газу дуже мало в атмосфері, всього 0,012 від усієї маси газу водню. Дейтерій входить до складу важкої води. Її формула D2O. Її фізичні властивості відрізняються від фізичних властивостей звичайної води. Таб.1.
Порівняння фізичних властивостей важкої води зі звичайною.
6. Війна за важку воду

Мал. 3. Завод з виробництва важкої води в Норвегії
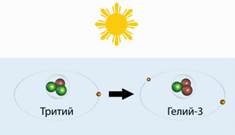
До складу тритію входить 2 нейтрона і 1 протон. Позначається Буквою Т.. Тритій - це короткоживучий ізотоп водню. Він народжується у верхніх шарах атмосфери під дією космічних променів.
Народжується, щоб тут же померти - перетворитися в гелій-3.
Його всього 6 грам у всій нашій атмосфері. 1 атом тритію доводиться на 10 см3 повітря.
7. Де застосовують тритій?
Запаси природного тритію є нікчемною. Тому весь тритій, який використовується в промисловості, отримують штучно. Шляхом бомбардування нейтронами атомів літію. Тритій використовується для створення світлочутливих фарб, які наносяться на різні прилади. Наприклад, це можна побачити на люмінофорних годиннику, у яких світяться стрілки в темряві. Запаси тритію в організмі людини є нікчемною. Але все-таки ми отримуємо тритій в організм з повітря і з їжею.
Газоподібний тритій в 500 разів менш токсичний, ніж тритій, що входить до складу надважкої води для людського організму. Це пояснюється тим, що газоподібний тритій виводиться з організму через три хвилини, а тритій, що входить до складу надважкої води, через 10 діб. Таким чином, люди, які іноді поглинають надважку воду, підвищують рівень радіації свого організму. Треба відзначити, що якщо людина носить годинник, стрілки якого покриті люмінофором з використанням тритію, в 5 разів більше схильний до радіації, ніж звичайна людина.
Те, що водень має три ізотопи, не виділяє його серед хімічних елементів. Ізотопи водню відрізняються один від одного і за фізичними і за хімічними властивостями. Це не характерно для інших атомів. Ізотопи водню відрізняються один від одного і за фізичними і за хімічними властивостями, тому що мають дуже різну масу. Вивчаючи ізотопи водню, вчені прийшли до висновку, що хімічні властивості елемента зручно вивчати на прикладі їх ізотопів.
Так народилася нова галузь хімії - хімія ізотопів.
8. Ядро атома
Ядра, які мають однакове число нейтронів, але різну кількість протонів називаються Ізотон. Ізотон. Назва «Ізотон» було придумано на основі слова «ізотоп». Шляхом заміни «п» (протон) на «н» (нейтрон). Прикладами Ізотон можуть служити ізотопи і. Нескладно порахувати, що в цих Ізотон по 7 нейтронів.
Нукліди з однаковим масовим числом називаються ізобари. ізобар; ін-греч.ἴσος (isos) - «однаковий» + βάρος (baros) - «вага»). Наприклад:. Кількість і протонів і нейтронів в ізобарах різний.
Атомне ядро складається з протонів, позитивно заряджених і нейтронів, що не мають заряду. Кожна з цих частинок має масу 1 а. Є.М. Кількість протонів і нейтронів в ядрі визначає масове число атома. Якщо число протонів в ядрі постійно, а кількість нейтронів різний, такі атоми називаються ізотопами.
Підбиття підсумку уроку.
На уроці ви повторили, що собою являє елементарна модель атома, її будова, схоже на нашу Сонячну систему. Дізналися, в якому році фізики дізналися на досвіді Резерфорда, з чого насправді складається атомне ядро, його щільність, як можна отримати новий елемент шляхом додавання до нього протона.
Список рекомендованої літератури
Рекомендовані посилання на ресурси інтернет
Рекомендоване домашнє завдання
2. Що таке ізотопи, Ізотон і ізобари?
3. Перерахуйте ізотопи водню, їх назви і склад.
Завантаження.
Потрібно завантажити поурочні плани по темі »Склад атомних ядер. Ізотопи (хімія 9 клас). Тисни посилання
Завантаження.
Популярні твори
- Пейзажі в ліриці А. С. Пушкіна
- Аналіз вірша А. Блоку «На полі Куликовому»
- Батько і син в оповіданні Д. Олдріджа "Останній Дюйм"
- Життя і творчість Гете В. І
- Рішення арбітражного суду. завдання
- Проектування підприємства громадського харчування Проектування закусочної. Частина 2
- А. С. Пушкін і С. А.Есенін про російську природу
-
Статистика проекту