Урок присвячений вивченню теми «Аміак і солі амонію». Учитель розповість про властивості сполук азоту, в яких він проявляє ступінь окислення -3. Ви дізнаєтеся, в які хімічні реакції і за яких умов вступає аміак, а також як розпізнати солі амонію серед інших речовин.
Отримання і властивості аміаку
При високій температурі і високому тиску в присутності платинового каталізатора азот реагує з воднем з утворенням аміаку:
Ця реакція має велике практичне значення, так як аміак використовується для виробництва азотних добрив.
Розглянемо властивості аміаку. Це безбарвний газ з різким запахом, добре розчиняється у воді. Водний розчин аміаку називається нашатирним спиртом.
Аміак здатний взаємодіяти з киснем. При горінні аміаку утворюється азот і вода:
Якщо для процесу окислення аміаку використовувати каталізатор - платину, то процес прискорюється і утворюється оксид азоту (II) і вода:
Аміак здатний взаємодіяти з хлороводородом. При цьому утворюється речовина, що відноситься до класу солей - хлорид амонію (рис. 1):

Мал. 1. Реакція між аміаком і хлороводородом
Розглянемо механізм даної реакції (рис. 2). При утворенні ковалентного полярного зв'язку з атомами водню азот використовує 3 електрона, а два електрона залишаються вільними. До цих двох електронів притягається атом водню, що має частковий позитивний заряд. В результаті утворюється катіон амонію NH4 + і хлорид-аніон. NH4Cl - сіль, хлорид амонію. У цій реакції аміак поводиться як підстава.
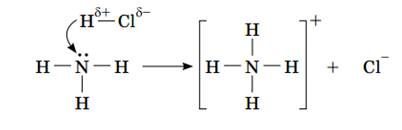
Мал. 2. Схема реакції між аміаком і хлороводородом
Аміак здатний реагувати і з іншими кислотами, розчинними у воді. В результаті таких реакцій утворюються відповідні солі амонію.
Розпізнавання солей амонію
Солі амонію можна розпізнати за допомогою характерної реакції - взаємодії з лугами. В результаті цих реакцій виділяється аміак, який легко розпізнається за характерним запахом.
Наприклад, при взаємодії хлориду амонію з гідроксидом натрію утворюється хлорид натрію, аміак і вода:
NH4Cl + NaOH = NaCl + NH3 + H2O
Додаткові рекомендовані посилання на ресурси мережі Інтернет
Завантаження.
Завантаження.
Популярні твори
- Пейзажі в ліриці А. С. Пушкіна
- Аналіз вірша А. Блоку «На полі Куликовому»
- Батько і син в оповіданні Д. Олдріджа "Останній Дюйм"
- Життя і творчість Гете В. І
- Рішення арбітражного суду. завдання
- Проектування підприємства громадського харчування Проектування закусочної. Частина 2
- А. С. Пушкін і С. А.Есенін про російську природу
-
Статистика проекту
Схожі статті