Вуглеводні, в молекулі яких крім простих σ-зв'язків вуглець - вуглець і вуглець - водень є вуглець-вугле- рідні π-зв'язку, називаються ненасиченими. Так як освіта π-зв'язку формально еквівалентно втрати молі-Кулой двох атомів водню, то ненасичені вуглеводні містять на 2п атомів водню менше, ніж граничні, де п - число π -зв'язків:
Ряд, члени якого відрізняються один від одного на (2Н) n. називається ізологіческім поруч. Так, у наведеній вище схемі изологов є гексани, гекса, гексадіени, гексіни, гексатріени і т. Д.
Вуглеводні, що містять одну π-зв'язок (т. Е. Подвійну зв'язок), називаються алкенами (олефинами) або, по першому члену ряду - етилену, етиленовими вуглеводнями. Загальна формула їх гомологічного ряду Сп Н2л.
Відповідно до правил ІЮПАК при побудові назва-ний алкенов найбільш довга вуглецевий ланцюг, що містить подвійну зв'язок, отримує назву відповідного алкана, в якому закінчення -а замінено на ен. Цей ланцюг нумерується таким чином, щоб вуглецеві атоми, які беруть участь в утворенні подвійного зв'язку, отримали номери, найменші з можливих:
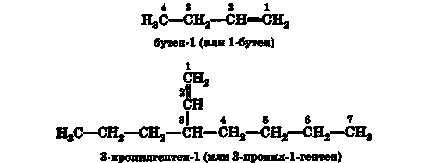
Радикали називаються і нумеруються як і в разі алканів.
Для алкенів порівняно простого будови дозволяється застосовувати більш прості назви. Так, деякі найбільш часто зустрічаються алкени називають, додаючи суфікс-ен до назви вуглеводневої радикала з тим же вуглецевим скелетом:
Вуглеводневі радикали, утворені з алкенів, по-лучают суфікс -еніл. Нумерація в радикал починається від вуглецевого атома, що має вільну валентність. Однак для найпростіших алкенільних радикалів замість систематичен-ських назв дозволяється використовувати тривіальні:
Водневі атоми, безпосередньо пов'язані з ненасить-щеннимі атомами вуглецю, що утворюють подвійну зв'язок, часто називають вініл'нимі атомами водню,
Крім ізомерії вуглецевого скелета, в ряду алкенів по-є ще і ізомерія положення подвійного зв'язку. У загальному вигляді ізомерія такого типу - ізомерія положення заступника (функції) - спостерігається у всіх випадках, коли в молі-куле є які-небудь функціональні групи. Для алкана С4 Н10 можливі два структурних ізомери:
Для алкена С4 Н8 (бутена) можливі три ізомеру:
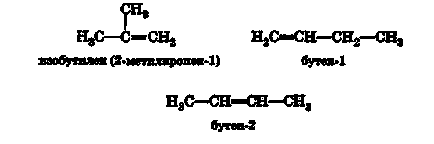
Бутен-1 і бутен-2 є ізомерами положення функ-ції (в даному випадку її роль виконує подвійний зв'язок).
Просторові ізомери розрізняються просторовим розташуванням заступників відносно один одного і називаються цис-ізомерами, якщо заступники розташовані по одну сторону від подвійного зв'язку, і транс-ізомерами, якщо по різні боки:
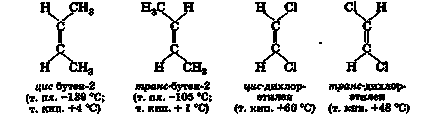
3. Будова подвійного зв'язку
Енергія розриву молекули по подвійному зв'язку С = С дорівнює 611 кДж / моль; так як енергія σ-зв'язку С-С дорівнює 339 кДж / моль, то енергія розриву π-зв'язку дорівнює лише 611-339 = 272 кДж / моль. π-електронів значно легше σ -електронів піддаються впливу, наприклад, поляризують розчинників або впливу будь-яких атакуючих реагентів. Це пояснюється відмінністю в симетрії распреде-лення електронного хмари σ- і π-електронів. Максимальна перекривання р-орбіталей і, отже, мінімальна сво-Бодня енергія молекули реалізуються лише при плоскому будів-еніі вінільного фрагмента і при скороченому відстані С-С, що дорівнює 0,134нм, тобто значно меншому, ніж рас-стояння між вуглецевими атомами, пов'язаними простий зв'язком (0,154 нм). З поворотом «половинок» молекули відноси-кові один одного по осі подвійного зв'язку ступінь перекривання орбіталей знижується, що пов'язано з витратою енергії. Причинами-Вієм цього є відсутність вільного обертання по осі подвійного зв'язку і існування геометричних ізомерів при відповідному заміщенні у атомів вуглецю.
4. Фізичні властивості
Як і алкани, нижчі гомологи ряду найпростіших алкенів при звичайних умовах - гази, а починаючи з С5 - нізкокіпя-щие рідини.
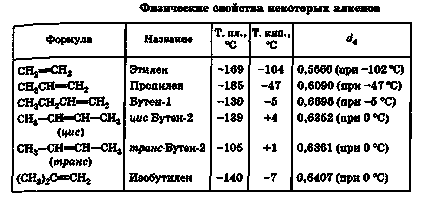
Все алкени, як і алкани, практично нерозчинні в воді і добре розчинні в інших органічних розчинників-лях, за винятком метилового спирту; всі вони мають мень-шую щільність, ніж вода.
5. Хімічні властивості
При розгляді реакційної здатності складних ор-ганических з'єднань діє загальний принцип. У біль-шинстве реакцій бере участь не «інертний» вуглеводневий радикал, а наявні функціональні групи і їх найближ-шиї оточення. Це природно, бо більшість зв'язків менш міцні, ніж зв'язку С-С і С-Н, і, крім того, зв'язку в функціонально-нальної групі і поблизу неї найбільш поляризовані.
Природно очікувати, що реакції алкенів будуть проходити за подвійним зв'язком, яку теж можна вважати функциональ-ної групою, а отже, будуть реакціями приєднатися-ня, а не реакціями заміщення, характерними для раніше рас-смотренних алканів.
Приєднання водню до алкенам призводить до утворення алканів:
Приєднання водню до етиленовим з'єднанням в від-присутність каталізаторів відбувається лише при високих темпе-ратура, при яких часто починається розкладання органіч-ських речовин. Значно легше приєднання водню йде в присутності каталізу-торів. Каталізаторами служать метали платинової групи в дрібнодисперсному стані, сама платина і особ-но паладій - вже при звичайній температурі. Велике прак-тичні значення мало відкриття Сабатье, що застосував спеціально приготовлений мелкораздробленного нікель при температурі 150-300 ° С і в численних роботах поки-завше універсальність цього каталізатора для цілого ряду реакцій відновлення.
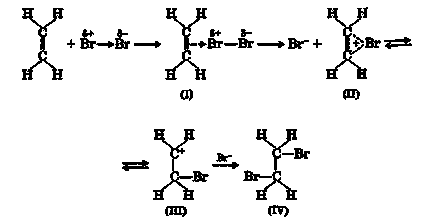
Галогени приєднуються до алкенам з утворенням дігалогенопроізводних, що містять атоми галогену у сусідніх атомів вуглецю:
На першій стадії цієї реакції відбувається взаємодія між π-електронами подвійного зв'язку і електрофільної часткою галогену з утворенням π-комплексу (I). Далі π-комплекс перегруповуються в Онієву (бромоніевий) іон (II) з ощепленіем аниона галогену, що знаходиться в рівновазі з карбкатион (III). Потім аніон атакує Онієву іон з утворенням продукту приєднання (IV):