До складу органічних карбонових кислот в якості функціональної входить карбоксильна група
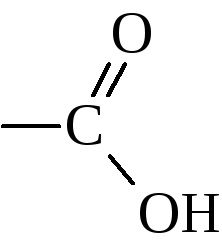
Залежно від числа цих груп розрізняють одно-, дво-, три- ... багатоосновні кислоти. Залежно від типу приєднаного до карбоксилу радикала вони зазвичай підрозділяються на аліфатичні (насичені і ненасичені), алициклические, ароматичні і т.д.
5.1 Алифатические карбонові кислоти
5.1.1 Одноосновні насичені кислоти
Відповідний ряд цих кислот починається мурашиної кислотою
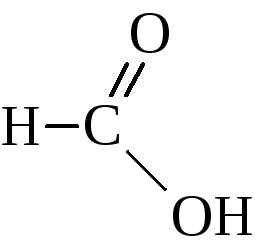
Ізомерія кислот цього ряду визначається будовою вуглеводневого радикала при карбоксильної групі і починається з четвертого члена ряду. Тривіальні назви карбонових кислот зробили щеплення дуже міцно і широко використовуються поряд з назвами по номенклатурі ІЮПАК. Назви кислот по цій номенклатурі виробляються від назви відповідного вуглеводню з додаванням суфікса -овая кислота. Іноді ці кислоти називають як похідні оцтової кислоти.
- Способи, засновані на окисленні:
а) окислення первинних спиртів (див. тему «Гідроксісоедіненія»);
б) окислення альдегідів (див. тему «Карбонільні з'єднання»);
в) окислення граничних вуглеводнів киснем повітря на каталізаторі. При окисленні синтину (див. Тему «Алкани») цей спосіб дає суміш кислот з різною довжиною ланцюга і використовується в промисловості при виробництві миючих засобів.
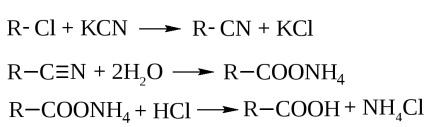
- Гідроліз нітрилів. які отримують дією ціаніду калію на галогеналкіли
- Гідроліз гемінальних трігалогеналканов
- Синтез через магнійорганіческіе з'єднання
- оксосинтезом - промисловий метод отримання карбонових кислот. Він полягає в дії на олефіни оксиду вуглецю (II) і водяної пари при 300 ... 400 ° С в присутності каталізаторів (наприклад, Ni (CO) 4)
Мурашина, оцтова і пропіонова кислоти легкорухливі безбарвні рідини з характерним гострим запахом. З водою змішуються в усіх відношеннях. Кислоти С4 - С9 - маслянисті рідини. Розчинність їх у воді сильно зменшується з ростом молекулярної маси. Кислоти С10 і вище - тверді кристалічні речовини, нерозчинні у воді.
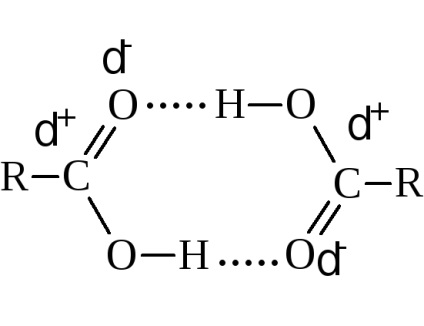
Температури кипіння їх ростуть у міру збільшення молекулярної маси. Порівняно зі спиртами, що мають те ж число вуглецевих атомів, кислоти киплять вище. Наприклад, етиловий спирт кипить при 78,3 ° С, а оцтова кислота - при 118,5 ° С. Це пояснюється більшою асоціацією молекул кислоти і утворенням нею більш міцних ассоциатов. Фізичні вимірювання вказують в основному на дімерізацію за рахунок водневих зв'язків.
Кислоти з парним числом вуглецевих атомів плавляться при більш високій температурі, ніж кислоти з непарним числом.
- Карбонові кислоти - це протонні кислоти. При діссоці-ації вони виділяють протон
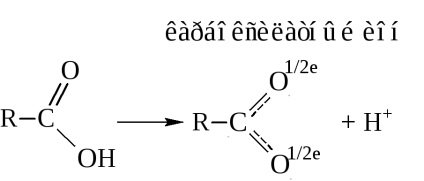
Кислотні властивості пояснюються перерозподілом електронної густини в карбоксильної групі в сторону кисню.
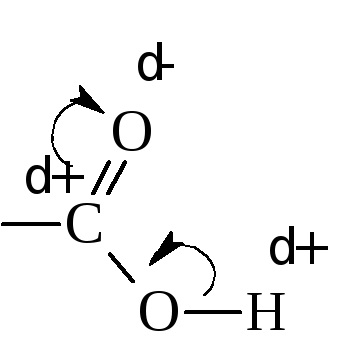
Внаслідок цього зв'язок Про - Н послаблюється і порівняно легко розривається. Величина константи дисоціації фактично залежить від величини дрібного позитивного заряду на Карбоксильні вуглеці. Чим він вищий, тим сильніше кислота. Ступінь дисоціації або, іншими словами, сила кислот залежить також від величини і характеру радикала. з'єднаного з карбоксильною групою. Алкільні радикали за допомогою індукційного ефекту підвищують електронну щільність в карбоксилом (знижують позитивний заряд на Карбоксильні вуглеці), тим самим, знижуючи силу кислоти.
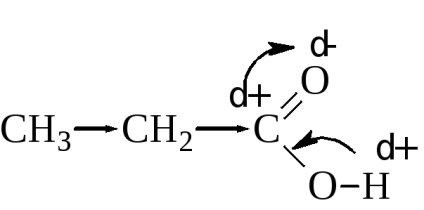
Зі збільшенням алкільного радикала константи дисоціації карбонових кислот дещо зменшується. Так, константа дисоціації мурашиної кислоти Н-СООН 2,17 · 10 -4. оцтової СН3 -СООН 1,76 · 10 -5 і капронової СН3 -СН2 -СН2 -СН2 -СН2 -СООН 1,31 · 10 -5.
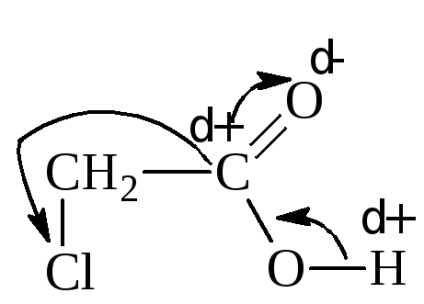
Введення в радикал електрофільної, електронооттягівающей групи, навпаки, збільшує силу кислоти. Наприклад, константа дисоціації хлоруксусной кислоти 1,40 · 10 -3.
- Як всякі кислоти, карбонові кислоти здатні до утворення солей з металами, їх оксидами і гідрооксидами
Піролізу кальцієвих солей отримують альдегіди і кетони, пиролизом натрієвих в присутності NаОН - вуглеводні.
- При дії на кислоти галогенідів фосфору або тіонілгалогеніда утворюються галогенангідриди кислот
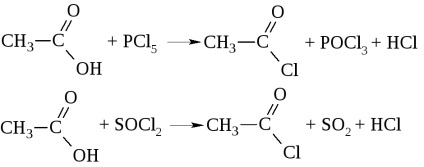
Галогенангідриди кислот називають по кислоті і галогенних (хлорангидрид оцтової кислоти), а також по кислотному радикалу ацил
У галоидангидридами кислот галоид надзвичайно рухливий і легко вступає в реакції обміну. Причиною рухливості галоида є великий позитивний заряд на вуглеці (δ +), який пов'язаний відразу з двома електронооттягівающімі атомами - киснем і галогеном.
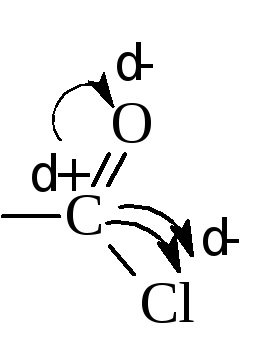
Цей вуглець легко піддається атаці нуклеофільних реагентів.
У реакціях галогенангидридов з сполуками, що містять метали або активний атом водню, відбувається заміна атомів металу або водню на ацил. Реакція називаетсяацілірованіем. Наприклад, в разі оцтової кислоти - це ацетилювання.
Ацилированием отримують цілий ряд похідних кислот. солі, ангідриди, складні ефіри, аміди, нітрили і ін. Наприклад:
а) гідроліз хлорангидрида або ацетилювання води
б) алкоголиз хлорангидрида або ацетилювання спиртів
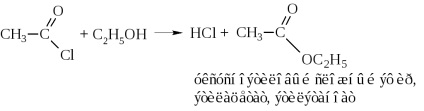
в) аммоноліз хлорангидрида або ацетилювання аміаку
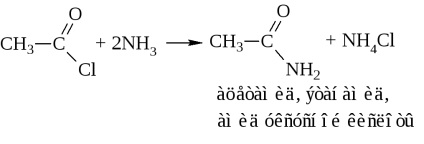
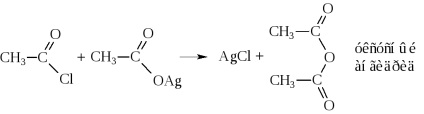
- В результаті відщеплення води від двох молекул кислоти також утворюються ангідриди кислот
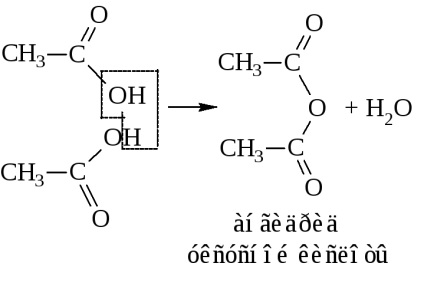
або ангідрид метанова кислоти
Таким шляхом ангідриди виходять лише в дуже жорстких умовах: або в присутності сильних водоотнимающих засобів (Р2 ПРО5), або в присутності каталізаторів (Al2 O3) при високих температурах. Зазвичай їх синтезують дією галогенангидридов на солі кислот
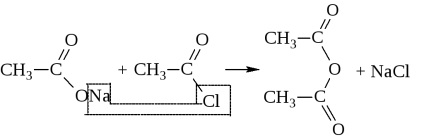
Ангідрид можуть утворювати і дві різні кислоти.
Ангідриди кислот - речовини дуже активні:
з водою вони дають відповідні кислоти
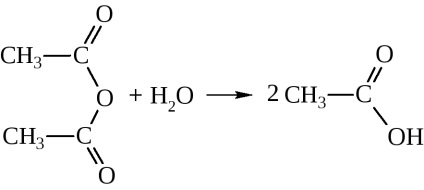
зі спиртами і аміаком утворюють суміші кислот зі складними ефірами і амидами відповідно.
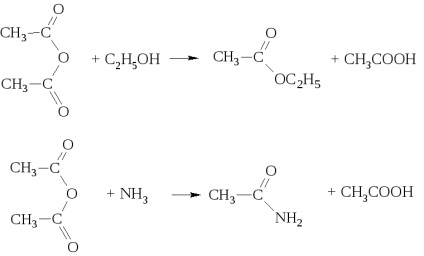
Ангідриди кислот є хорошими ацилуючий засобами. Однак половина молекули ангідриду не ацилуючий, а виділяється у вигляді кислоти.
- Аміди кислот. Їх зазвичай отримують через галогенангідриди та ангідриди кислот (див. Вище). У промисловості аміди синтезують дією аміаку на кислоти
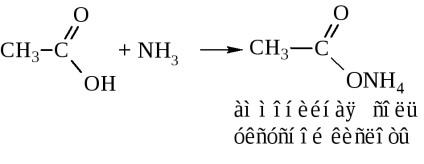
При сухій перегонці амонійна сіль виділяє воду з утворенням аміду
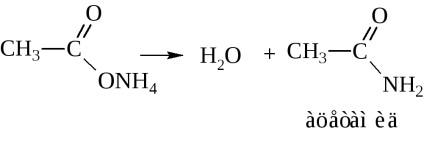
Ацетамід по номенклатурі ІЮПАК буде називатися етанамідом.
При ацилированием амінів виходять алкіл- і діалкіламіди, що мають промислове значення.
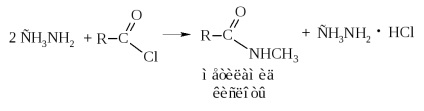
- Складні ефіри можна отримувати прямим взаємодією кислоти зі спиртом, тобто реакцією етерифікації кислот спиртами в присутності кислого каталізатора
Ця реакція давно цікавила хіміків. У 1862 році Бертло встановив, що реакція обратімаі рівновагу настає, коли прореагує приблизно ПО2 / 3моль вихідних речовин. В кінці ХІХ століття Н. А. і Н. Б. Меншуткин виявили, що швидкість реакції етерифікації залежить від будови кислоти і спирту. Було встановлено, що швидкість етерифікації падає при збільшенні числа і обсягу радикалів при α-вуглецевому атомі по відношенню до карбоксилу. Цей факт, очевидно, пояснюється екрануванням вуглецевого атома карбоксилу заміщають радикалами.
За допомогою мічених атомів (ізотоп кисню Про 18) було показано, що вода при етерифікації утворюється за рахунок гідроксилу кислоти і водню спирту
Назви складних ефірів по тривіальної номенклатури будуються за такою схемою: назва радикала спирту плюс назва кислотного радикала, в якому закінчення іл замінено на -ат. За номенклатурою ІЮПАК: назва радикала спирту плюс назва кислоти, в якому закінчення -овая замінено на -оат.
Як показано вище, складні ефіри можна також отримувати взаємодією спиртів з ангідридами і галогенангідриди кислот.
В реакції з спиртами складні ефіри здатні обмінюватися з ними радикалами. Ця реакція називається переетерифікації.
Хоча в карбоксильної групі спостерігається значний зсув електронної щільності до кисню, вуглецевий атом карбоксилу володіє не настільки великим позитивним зарядом, як вуглець карбонила в кетонах і альдегідах. Це обумовлено часткової нейтралізацією електронної ненасиченості вуглецю зміщенням електронів від гідроксилу
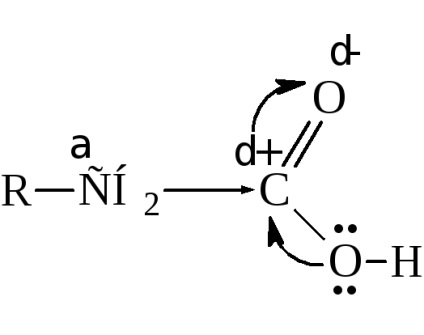
І все ж карбоксил впливає на з'єднаний з ним вуглеводневий радикал, відтягуючи на себе електронну щільність і підвищуючи активність водневих атомів, перш за все у α-вуглецю.
Пряме хлорування і бромування карбонових кислот відбувається на світлі з вступом галогенів вα-положення.
Звичайним же способом сінтезаα-галогензамещённих кислот є метод Гелль-Фольганд-Зелінського. що полягає в дії на карбонову кислоту молекулярного хлору або брому в присутності фосфору
Інший метод синтезу, що призводить до β-галогензамещенним кислотам, полягає в гідрохлорірованііα, β-ненасичених карбонових кислот
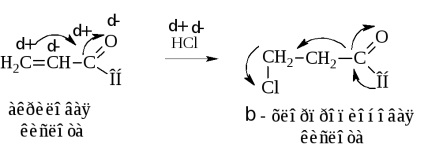
Приєднання НCl протікає всупереч правилу Марковникова через зсув електронної щільності по системі сполучення молекули до кисню і відповідно до зарядами атомів.
Дія галогеноводородних кислот на гідроксикислоти також призводить до бажаного результату
Замещеніеα-водню галогеном значно підвищує силу кислоти. Галоген сильно відтягує електронну пару від α-вуглецю, оголюючи його позитивний заряд. Він, в свою чергу, через вуглець карбоксилу притягує до себе електрони гідроксильної групи. Таким чином, за допомогою індукційного ефекту, протон гідроксилу активується. Подібна картина, правда, менш виражено, спостерігається і при видаленні галогену від карбоксилу.
При заміні водню в радикала кислоти на I, Br, Cl, F, а також збільшення числа атомів галогену, послідовно збільшується сила і константи дисоціації кислот (К).
Галогенкіслоти завдяки великій активності знайшли широке застосування.
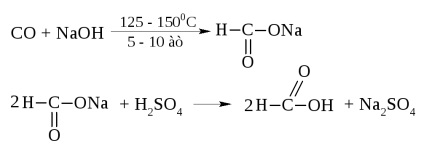
Мурашина кислота - рідина з tкип = 100,8 ° C і різким запахом. При попаданні на шкіру викликає опіки.
У промисловості її отримують з оксиду вуглецю і їдкого натру
Мурашина кислота займає особливе місце в ряду кислот. Поряд з карбоксилом в ній може бути виділена і альдегидная група.
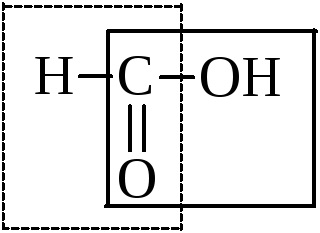
Тому, володіючи всіма властивостями кислот, вона вступає в реакції окислення: срібного дзеркала, з фелінгової рідиною, - тобто в типово альдегідні реакції.
Мурашина кислота використовується для дезінфекції в медицині і промисловості, при фарбуванні тканин, в ряді синтезів.
Безвода оцтова кислота при температурі +16,6 ° С застигає і називається тому крижаний. температуру кипіння. = 118,5 ° С.
Отримують її гідратацією ацетилену, окисленням етилового спирту і граничних вуглеводнів, оцтовокислим бродінням цукристих речовин та іншими методами.
У хімічному відношенні - це звичайна карбонова кислота.
Застосовується як прекрасний розчинник, в шкіряному виробництві, лакофарбової, харчової, хімічної та інших галузях промисловості. Причому витрачається у великих кількостях.
Вищі жирні кислоти
Найбільш відомі пальмітинова С15 Н31 СООН і стеаринова С17 Н35 СООН кислоти. Ці кислоти мають молекули з нормальною ланцюжком вуглецевих атомів. Їх отримують при обмиленні жирів і каталітичним окисленням парафінів.
Солі цих кислот - мила. Натрієві і калієві солі цих кислот добре розчинні у воді і добре «миляться». Солі магнію, кальцію, барію та ін. (Солі жорсткості) погано розчиняються у воді. Тому в жорсткій воді звичайні мила переходять в нерозчинний стан і не «миляться».
Для виготовлення свічок використовують тверду суміш вищих жирних кислот - стеарин.