Ненасичені вуглеводні РЯДУ ацетилену (алкінілу)
Алкіни - аліфатичні ненасичені вуглеводні, в молекулах яких між вуглецевими атомами є одна потрійний зв'язок.
Вуглеводні ряду ацетилену є ще більш неграничними сполуками, ніж відповідні їм алкени (з тим же числом вуглецевих атомів). Це видно з порівняння числа атомів водню в ряду:
1. БУДОВА АЛКИНОВ
Першим і основним представником гомологічного ряду алкінів є ацетилен (Етін) С2 Н2. Будова його молекули виражається формулами: За назвою першого представника цього ряду - ацетилену - ці ненасичені вуглеводні називаютацетіленовимі.
У алкінілу атоми вуглецю знаходяться в третьому валентних станів (sp-гібридизація). У цьому випадку між вуглецевими атомами виникає потрійний зв'язок, що складається з однієї s- і двох p-зв'язків. Довжина потрійний зв'язку дорівнює 0,12 нм, а енергія її освіти становить 830 кДж / моль. Моделі просторової будови ацетилену представлені на малюнку: 2. НОМЕНКЛАТУРА І ізомерів
Номенклатура. За систематичною номенклатурою ацетиленові вуглеводні називають, замінюючи в алканах суфікс -а на суфікс-ін. До складу головного ланцюга обов'язково включають потрійну зв'язок, яка визначає початок нумерації. Якщо молекула містить одночасно і подвійну, і потрійну зв'язку, то перевагу в нумерації віддають подвійного зв'язку:
За раціональної номенклатурі алкіновие з'єднання називають, як похідні ацетилену.
Ненасичені (алкіновие) радикали мають тривіальні або систематичні назви:
Ізомерія. Ізомерія алкінових вуглеводнів (як і алкенових) визначається будовою ланцюга і положенням в ній кратної (потрійний) зв'язку:
3. ОТРИМАННЯ АЛКИНОВ
Ацетилен в промисловості і в лабораторії можна отримувати наступними способами:
1. високотемпературного розкладу (крекінг) природного газу - метану:
2СН4 1500 ° C -> НСєСН + 3Н2
2. Розкладання водою карбіду кальцію СаС2. який отримують спіканням негашеного вапна СаО з коксом:
СаО + 3C 2500 ° C -> CaC2 + CO
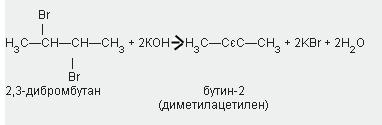
3. У лабораторії похідні ацітілена можна синтезувати з дігалогенопроізводних, що містять два атоми галогену при одному або сусідніх вуглецевих атомах, дією спиртового розчину лугу:
4. ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ
Фізичні властивості. Ацетиленові вуглеводні, що містять в молекулі від двох до чотирьох вуглецевих атомів (при звичайних умовах), - гази, починаючи з C5 H8 - рідини, а вищі Алкіни (з С16 Н30 і вище) - тверді речовини. Фізичні властивості деяких алкинов показані в табл. 1.
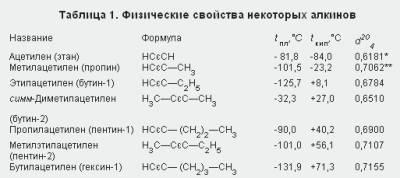
** При температурі-50 ° С.
Хімічні властивості. Хімічні властивості алкінів визначаються потрійним зв'язком, особливостями її будови. Алкіни здатні вступати в реакції приєднання, заміщення, полімеризації і окислення.
Реакції приєднання. Будучи неграничними сполуками, Алкіни вступають в першу чергу в реакції приєднання. Ці реакції протікають поступово: з приєднанням однієї молекули реагенту потрійний зв'язок спочатку переходить в подвійну, а потім, у міру подальшого приєднання, - у одинарну. Здавалося б, Алкіни, володіючи двома p-зв'язками, набагато активніше повинні вступати в реакції електрофільного приєднання. Але це не зовсім так. Вуглецеві атоми в молекулах алкинов розташовані ближче один до одного, ніж в алкенів, і мають більшу електронегативність. Це пов'язано з тим, що електронний торгівельний атома вуглецю залежить від його валентного стану. Тому p-електрони, перебуваючи ближче до ядер вуглецю, виявляють дещо меншу активність в реакціях електрофільного приєднання. Крім того, позначається, близькість позитивно заряджених ядер атомів, здатних відштовхувати наближаються електрофільні реагенти (катіони). У той же час Алкіни можуть вступати в реакції нуклеофіли приєднання (зі спиртами, аміаком та ін.).
1. Гідрування. Реакція протікає в тих же умовах, що і в разі алкенов (каталізатори Pt, Pd, Ni). При відновленні алкинов спочатку утворюються алкени, а потім - алкани: CHєCH + H2 -> CH2 = CH2 + H2 -> CH3 -CH3
2. Галогенування. Ця реакція протікає з меншою швидкістю, ніж в ряду етиленових вуглеводнів. Реакція також проходить сту пенчато:
3. гідрогалогенірованіе. Реакції приєднання галогеноводородов, як і галогенів, йдуть в основному за механізмом електрофільного приєднання:
Друга молекула галогеноводорода приєднується відповідно до правила Марковникова.
4. Приєднання води (реакція М.Г.Кучерова ,. 1881). Каталізатор - сіль ртуті:
HCєCH + HOH -> 2 = CH-OH> (проміжний нестійкий продукт) (вініловий спирт)
Нестійкий проміжне з'єднання - вініловий спирт - перегруповуються в оцтовий альдегід.
5.Прісоедіненіе синильної кислоти:
НСєСН + HCN кат. -> H2 C = CH-CN (акрилонітрил)
Акрилонитрил - цінний продукт. Він використовується в якості мономера для отримання синтетичного волокна - нитрон.
6. Приєднання спирту. В результаті цієї реакції утворюються прості вінілові ефіри (реакція А. Е.Фаворского):
Приєднання спиртів в присутності алкоголятов - типова реакція нуклеофільного приєднання.
Реакція ізомеризації. Ацетиленові вуглеводні, як алкани і алкени, здатні до ізомеризації з переміщенням потрійний зв'язку:
Реакції полімеризації. Ацетилен в залежності від умов реакції здатний утворювати різні продукти полімеризації - лінійні або циклічні:
НСєСН + НСєСН -> НСєСН-CН = CH2 [sup] (при 80г.ц. і Cu2 Cl2, утворюється вінілацетилен)
Ці речовини становлять великий інтерес. Наприклад, при приєднанні до вінілацетілену хлороводню утворюється хлоропрен, який в якості мономера використовується у виробництві хлоропренового каучуку:
Реакція окислення. Ацетилен легко Кісляй. При цьому відбувається розрив молекули за місцем потрійного зв'язку. Якщо ацетилен пропускати через окислювач (водний розчин перманганату калію), то розчин швидко знебарвлюється. Ця реакція є якісною на кратні (подвійні і потрійні) зв'язку:
При повному згорянні ацетилену на повітрі утворюються два продукти оксид вуглецю (IV) і вода:
При неповному згорянні утворюється вуглець (сажа):
5. ОКРЕМІ ПРЕДСТАВНИКИ
Ацетилен - цінний продукт для хімічної промисловості. З нього отримують синтетичний каучук, оцтовий альдегід і оцтову кислоту, етиловий спирт і багато інших речовин.
Вінілацетилен (бутен-1-ін-3) НСєC-СН = CН2 - газ з неприємним запахом. При відновленні утворює бутадієн-1,3, а при приєднанні хлороводню - 2-хлорбутадіен-1,3 (хлоропрен).
1) може застосовуватися в якості пального при газовому зварюванні і різанні металів;
2) використовується також для синтезу різних органічних сполук;
3) в результаті приєднання хлору до ацетилену отримують розчинник - 1,1,2,2-тетрахлоретан. Шляхом подальшої переробки тетрахлоретана виходять інші хлорпохідні;
4) при відщепленні хлороводню від 1,1,2,2-тетрахлоретана утворюється тріхлоретен - розчинник високої якості, який широко застосовується при чищенні одягу: СНСI = ССI2;
5) у великих кількостях ацетилен йде на виробництво Хлоретилу, або вінілхлориду, за допомогою полімеризації якого виходить полівінілхлорид (використовується для ізоляції проводів, виготовлення плащів, штучної шкіри, труб та інших продуктів);
6) з ацетилену виходять і інші полімери, які необхідні у виробництві пластмас, каучуків і синтетичних волокон.
24 вопросСпособи отримання галогенопроізводних граничних вуглеводнів
Заміщення водню в граничних вуглеводнях на галоген. При дії галогенів на граничні вуглеводні під впливом світла в результаті заміщення атомів водню утворюється галогеналкіни.
CH4 + Cl2 CH3Cl + HCl
Метан Хлористий метил
Однак при цьому утворюються і значні кількості полігалогенпроізводних.
При прямому Галогенування більш складних вуглеводнів заміщення водню може відбуватися у різних вуглецевих атомів. Так, наприклад, вже під час хлорування пропану реакція протікає за двома напрямками - утворюється суміш двох галогеналкілов
Отримання з ненасичених вуглеводнів. Галогеналкіни утворюються при приєднанні галогеноводородов до етиленовим вуглеводнів
При приєднанні до етиленовим вуглеводнів галогенів або до ацетиленовим - галогеноводородов утворюються дігалогенопроізводние. З ацетиленових і дієнових вуглеводнів в результаті приєднання галогенів можуть буть отримані різноманітні тетрагалогенпроізводние.
Отримання з спиртів. Найбільш зручним способом отримання галогеноалкілов є заміщення гідроксильної групи спиртів R- OH на галоген.
Якщо діяти на спирт галогенводород, то утворюється галогеналкіл
Однак разом з формуванням галогеналкіл і води остання буде гідролізувати галогеналкіл, і тому така реакція оборотна. Щоб отримати хорший вихід галогеналкіл, в реакцію вводять надлишок галогенводорода або ведуть її в присутності водооотнімающіх засобів (концентрованої сірчаної кислоти). наприклад:
Для отримання галогеналкілов зручно дію на спирти галогенних сполук фосфору. наприклад: