



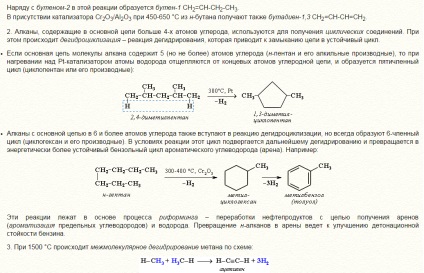
Нижчі (газоподібні) гомологи - метан, етан, пропан, бутан - легко спалахують і утворюють з повітрям вибухонебезпечні суміші, що необхідно враховувати при їх використанні. Зі збільшенням молекулярної маси алкани загоряються важче.




Хімічні властивості алканів
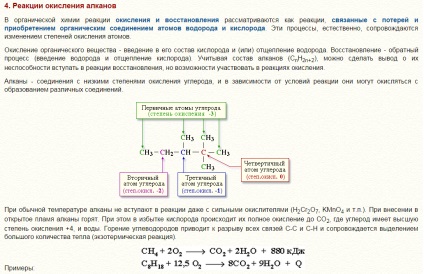
Алкани відносяться до вуглеводнів, в яких відсутні кратні зв'язку. Одна з назв вуглеводнів цього ряду - парафіни, позначає їх хімічну пасивність. Тому хімічні властивості алканів визначаються таким чином:
1. Через граничності алканів реакції приєднання для них не характерні.
2. Через міцних зв'язків С-С і С-Н (короткі і практично неполярні) слід мала реакційна здатність (не реагують з кислотами, лугами, KMnO4 і т.п.)
3. Не полярні зв'язків свідчить про те, що реакції можуть проходити по свободнорадикальному механізму.
Основний тип реакцій - радикальне заміщення (radical substitution) SR.
Розірвати зв'язок можна за допомогою нагрівання або УФ-випромінювання. Зазвичай реакції алканів йдуть при підвищених температурах або на сонячному світлі.
Взаємодія алканів з галогенами (елементи VII-A групи) носить загальну назву -реакція галогенування. Швидкість реакції залежить від активності галогенів, яка зменшується зі збільшенням радіуса атома.
Фтор хімічно дуже активний, і реакції алканів з його участю сопровождаютсявзривом і окисленням до CF4.
Взаємодія алканів з йодом практично не протікає.
Реакції хлорування і бромування проводять при 300-400оC або при опроміненні УФ-лампою.
Механізм реакції заміщення на прикладі хлорування метану
При хлоруванні атом Н в молекулі метану заміщається на атом Cl. В надлишку хлору відбувається подальше заміщення:
СН4 + Сl2 CH3Cl + HCl;
CH3Cl + Сl2 CH2Cl2 + HCl;
CH2Cl2 + Сl2 CHCl3 + HCl;
CHCl3 + Сl2 CCl4 + HCl.
Механізм реакції - послідовність стадій, через які проходить хімічна реакція.
Стадія 1 - зародження ланцюга (ініціація)
Коли молекулу хлору нагрівають або опромінюють, слабкий зв'язок між атомами хлору рветься, при цьому кожному з атомів при розриві зв'язку дістається по одному електрону.
В результаті утворюються незаряджені частинки з неспареним електроном - радикали. Атоми в радикалах містять на зовнішньому рівні непарне число електронів. Тому радикали - дуже нестійкі і реакційно здатні частинки.
Cl: Сl 2 Сl ·.
Стадія 2 - розвиток (зростання) ланцюга
Атом хлору при зіткненні з молекулою алкана відриває від неї атом Н, і утворюється молекула HCl. Виникає новий вільний радикал · СН3. Він далі реагує з іншою молекулою хлору. Такі взаємодії можуть повторюватися багато разів, утворюючи довгий ланцюг.
Сl · + CH4¾® HCl + · СН3;
· СН3 + Сl2¾® Сl · + CH3Сl ...
Стадія 3 - обрив ланцюга (рекомбінація)
Два радикала можуть зустрітися, і ланцюг перерветься:
· СН3 + Сl · ¾® CH3Сl;
2 Сl · ¾® Сl2;
2 · СН3¾® CH3-CH3.
Зверніть увагу: в останньому випадку виникає речовина, в молекулі якого більше атомів вуглецю, ніж у вихідному алканів. Тому в суміші продуктів радикальних реакцій алканів завжди присутні невеликі кількості речовин з більш довгою вуглецевої ланцюгом.
Особливості радикального заміщення
У реакцію радикального заміщення найлегше вступають атоми водню при третинному атомі С, потім при вторинному, а найскладніше розірвати зв'язок С-Н при первинному атомі вуглецю. Тому при бромуванні 2-метилбутан переважно утворюється 2-бром-2-метилбутан:
По механізму радикального заміщення протікає реакція нітрування алканів в газовій фазі (реакція Коновалова). Умови - підвищені температура і тиск.
У пароподібному стані азотна кислота розкладається:
2HNO3 2NO2 + ½ O2 + H2O.
Оксид азоту (IV) є радикалом · NO2. Він атакує молекулу алкана.
СH4 + HNO3 = СН3NO2 + H2O.
Мал. 1. Горіння метану
Горіння алканів (рис. 1.) також є радикальною ланцюговою реакцією, але, крім того - розгалуженої. На стадії розвитку ланцюга зустрічаються процеси, що призводять до розмноження радикалів (розгалуження). Фрагмент механізму горіння метану:
RH + O2 = R · + · HO2 (і ін.)
• Розвиток ланцюга:
R · + O2 = · RO2
· RO2 + RH = ROOH + R ·
ROOH = RO · + · OH
ROOH + RH = RO · + R · + H2O
2ROOH = · RO2 + RO · + H2O
Суміш метану з киснем (в об'ємному співвідношенні 1: 2) або з повітрям (1:10) при підпалюванні згорає з вибухом. Тому суміші метану, пропану, етану, бутану з повітрям дуже небезпечні. Вони іноді можуть утворитися в шахтах, в майстернях, в житлових приміщеннях. З цими газами потрібно проявляти обережність при застосуванні.
Отримання і застосування алканів
1. З природного і попутного нафтового газу
Найважливішим джерелом алканів в природі є природний газ, мінеральне вуглеводневу сировину - нафту і супутні їй нафтові гази. Природний газ на 95 відсотків складається з метану. Такий же склад має болотний газ, що утворюється в результаті переробки бактеріями (гниття) вуглеводів.
Метан називають ще й болотним; рудниковим газом.
Попутні нафтові гази складаються в основному з етану, пропану, бутану і частково пентана. Їх відокремлюють від нафти на спеціальних установках з підготовки нафти. При відсутності газоконденсатних станцій попутні нафтові гази спалюють у факелах, що є вкрай нерозумною і руйнівної практикою в нафтовидобутку. Одночасно з газами нафту очищається від води, бруду і піску, після чого надходить в трубу для транспортування. З нафти при її разгонке (перегонці, дистиляції) відбираючи послідовно все більш і більш висококиплячі фракції отримують:
бензини - т. кип. від 40 до 180 С, (містить вуглеводні С5-С10), складається більш, ніж з 100 індивідуальних сполук, нормальних і розгалужених алканів, циклоалканов, алкенов і ароматичних вуглеводнів;
легкий газойль (дизельне паливо) 230-305 С (С13-С17);
важкий газойль і легкий дістіллятсмазочного масла 305-405 С (С18-С25);
Залишок після перегонки нафти називається асфальтом або бітумом.
2. Синтезом з водяного газу:
n CO + (2n + 1) H2 - t, kat → CnH2n + 2 + n H2O
CO + 3H2 - t, kat → CH4 + H2O
3. Синтезом з простих речовин:
1. Граничні вуглеводні знаходять широке застосування в найрізноманітніших сферах життя і діяльності людини.
2. Використання в якості палива - в котельних установках, бензин, дизельне паливо, авіаційне паливо, балони з пропан-бутанової сумішшю для побутових плит
3. Вазелін використовується в медицині, парфумерії, косметики, вищі алкани входять до складу мастил, з'єднання алканів застосовуються в якості холодоагентів в домашніх холодильниках
4. Суміш ізомерних пентанов і гексанов називається петролейним ефіром і застосовується як розчинник. Циклогексан також широко застосовується як розчинник і для синтезу полімерів.
5. Метан використовується для виробництва шин і фарби
6. Значення алканів в сучасному світі величезна. У нафтохімічній промисловості граничні улеводороди є базою для отримання різноманітних органічних сполук, важливою сировиною в процесах отримання напівпродуктів для виробництва пластмас, каучуку, синтетичних волокон, миючих засобів і багатьох інших речовин. Велике значення в медицині, парфумерії та косметики.
Використання алканів в якості палива
Використання парафіну для отримання водостійкого паперу
Застосування алканів в медицині (вазелін, парафін та ін.)
Застосування галогенопроізводних алканів
Алкани: будова, номенклатура, одержання і фізичні властивості
Алкани: будова, номенклатура, одержання і фізичні властивості (розрахункові завдання)