Пероральні кишковорозчинні лікарські форми
Пероральні кишковорозчинні лікарські форми
В. В. Могилюк, менеджер служби інновацій Корпорації «Артеріум»
Це були перші задокументовані спроби отримання пероральних лікарських форм (ЛФ) стійких до середовища шлунка і вивільняє активний початок в кишечнику. Згодом, в 1884 р швейцарським фармацевтом була зроблена вдала спроба поліпшити кишковорозчинними покриття. Для розробки рецептур були використані Неперетравлювані в шлунку матеріали: жири, воски та гуми. Первинний успіх на ринку завершився розчаруванням, так як була виявлена тенденція кишковорозчинними покриття до абсорбції вологи, набухання і передчасного розриву. У 1895 р інший швейцарський фармацевт використав новий підхід - замочування наповнених желатинових капсул в розчині формальдегіду з наступним сушінням. Така обробка капсул зміцнюючих желатинову оболонку, уповільнює її розчинення, що дозволяло вивільнятися активному фармацевтичному інгредієнту (АФІ) в кишечнику. Роботодавець винахідника в 1904 р отримав патент на спосіб виробництва порожніх желатинових капсул за допомогою обробки желатину в формальдегіді, що дозволило йому вироблені в Німеччині капсули експортувати в США.
У 1938 р вчені (J. T. Gorleyі C. O. Lee) сфокусували свою увагу на трьох основних матеріалах: стеаринова кислота, смола Сандарак і шелак, які випробовувалися як окремо, так і в комбінації з іншими допоміжними речовинами (ексципієнтами). Вченими було виявлено, що при використанні спиртового розчину, що містить шелак (80 частин) і касторове масло (20 частин) вдається отримати відповідне кишковорозчинними покриття на поверхні як таблеток, так і капсул.
На сьогоднішній день фармація далеко відійшла від широкого використання екстемпоральних лікарських засобів. Для нанесення кишковорозчинних покриттів на таблетки, капсули, пелети, гранули (рис. 1), кристали (рис. 2), при промисловому виробництві лікарських засобів (ЛЗ), використовується різноманітне високотехнологічне фармацевтичної промисловості та робастні формуляції.
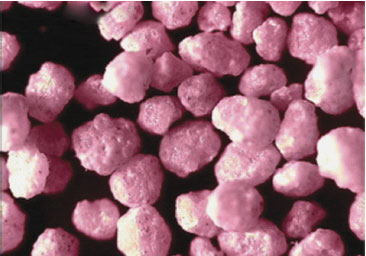
Мал. 1. Гранули, вкриті кишковорозчинною оболонкою
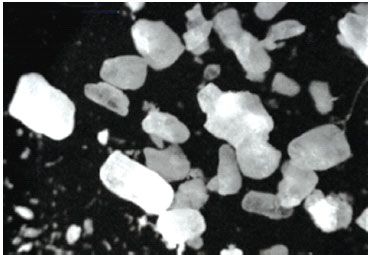
Мал. 2. Кристали ацетилсаліцилової кислоти, вкриті кишковорозчинною оболонкою
До технологічного обладнання, що використовується для нанесення стійких до шлункового соку покриттів, можна віднести: дражировочні котли, які традиційно використовуються в фармацевтичному виробництві; коатери - більш сучасні установки для нанесення плівкового і / або суспензійного покриття; спеціальні таблеткові преси для нанесення напресованих оболонок; установки для нанесення покриття в псевдозрідженому шарі, які з перерахованих вище є найбільш складними в управлінні технологічним процесом. Так як при нанесенні плівкового покриття в установках псевдозрідженого шару є можливість впливу на 10 взаємопов'язаних параметрів (в залежності від конфігурації установки кількість параметрів може варіювати).
На фармацевтичному ринку допоміжних речовин доступні різні типи полімерів, які розчиняються при різних значеннях pH - від 4,8 до 7,2. Ці полімери (наприклад: ацетат фталат целюлози, шелак, поліметакрилат), як правило, не використовуються самостійно. У рецептуру покриття можуть додатково входити функціональні допоміжні речовини: інші полімери, пластифікатори і пігменти. Кишковорозчинні і допоміжні речовини доступні як у вигляді монокомпонентів, так і у вигляді вже приготованих сумішей (наприклад, таких транснаціональних компаній як: ISP, BASF, Colorcon) які значно полегшують процес виробництва готових ЛФ. Використання готових сумішей знижує ризик відхилення якісних характеристик від серії до серії, в тому числі стійкості ЛФ в кислому середовищі. До формуляцій, що забезпечує pH-залежне вивільнення в кишечнику, пред'являється ряд вимог: переносимість шлунком і кишечником, оптимальна кінетика вивільнення АФІ; стійкість до механічного впливу, стабільність при зберіганні.
Розуміння фізіологічних процесів, пов'язаних зі шлунком, воротарем шлунка, дванадцятипалої кишкою є необхідним при розробці раціонального дизайну ЛФ, стійких до шлункового соку. Час перебування ЛФ в шлунку залежить від різних чинників: повний або порожній шлунок; природа їжі; щільність вмісту шлунка і ЛФ; розмір ЛФ або частинок, на які вона дезінтегрованих в шлунку. Необхідно звертати особливу увагу на фізико-хімічні властивості допоміжних речовин, розмір ЛФ або частинок, стійких до шлункового соку (капсули, наповнені пелетами, гранулами або кристалами, вкритими оболонкою; мікротаблеткі, таблетки або капсули, вкриті оболонкою); щільність ЛФ; можливість адгезії до стінки шлунка.
Для підтвердження стійкості ЛФ з кишковорозчинним покриттям до впливу pH шлунка і для контролю кінетики (профілю) вивільнення АФІ з ЛФ в кишечнику використовують in vitro тестування, яке складається з двох етапів. Перший етап здійснюється в 0,1 Н розчині соляної кислоти, який імітує умови шлунка, а другий - в фосфатному буфері при pH 6,8, який симулює середу кишечника. В ідеальному випадку в 0,1 Н розчині соляної кислоти АФІ не звільняє з ЛФ, а в фосфатному буфері при pH 6,8 вивільняється повністю. Кінетика in vitro корелює з in vivo кінетикою вивільнення АФІ, які зумовлюють профіль ефективності та безпеки препарату, тому in vitro тестування, як правило, стає предметом контролю якості.
Стійкі до шлункового соку кишковорозчинні ЛФ мають довгі традиції. Вони використовуються в якості систем доставки АФІ в тих випадках, коли АФІ:
- нестабільний в кислому середовищі шлунка (pH 1-3), наприклад, еритроміцин;
- може дратувати чи негативно впливати на слизову оболонку шлунка, викликати побічні ефекти, такі, як нудота і блювота - наприклад, аспірин, диклофенак, індометацин, напроксен та інші НПЗЗ;
- повинен надавати свою дію в кишечнику, наприклад, біфідо-і лактобактерії;
- абсорбується тільки в кишечнику.
Нижче наведені аспекти практичного застосування pH-залежного вивільнення АФІ.
Використовувані НПЗЗ можуть провокувати розвиток гастриту через запалення стінки шлунка. У світлі даної теми, Аспірин Кардіо (Байєр) як НПЗЗ проявляє антитромбоцитарну дію, може служити яскравим прикладом використання кишечнорастворимой оболонки. Для профілактики серцево-судинних подій призначають тривалі курси прийому аспірину в невеликих дозах (50 мг і 100 мг). Фахівці вважають, що кардіологічним хворим з метою антитромбоцитарної терапії слід призначати препарат в кишковорозчинною оболонці. Ця думка грунтується на дослідженнях, що продемонстрували мінімальний ризик застосування даної форми аспірину щодо частоти виникнення ерозивних і геморагічних змін в слизовій оболонці шлунково-кишкового тракту, в порівнянні зі звичайною формою ацетилсаліцилової кислоти.
Кишковорозчинні покриття знайшли застосування у виробництві пероральних ЛФ антибіотиків. Прикладом може служити еритроміцин - антибіотик системної дії, що поклав початок класу макролідів, який широко застосовується в амбулаторній практиці, особливо в педіатрії, для лікування пневмоній, бронхітів різної етіології, скарлатини, ангіни, гнійних отитів і ін. Інфекцій. Підстава еритроміцину є кіслотолабільного з'єднанням і при пероральному прийомі може в різній мірі инактивироваться під впливом соляної кислоти шлунка. Крім цього, на всмоктування еритроміцину впливають швидкість спорожнення шлунка і їжа. Тому біодоступністьпрепарату при оральному прийомі невисока і її ступінь може змінюватися у різних хворих, результатом чого є варіабельність концентрації антибіотика в крові. Це послужило поштовхом до розробки та впровадження в клінічну практику солей, ефірів, солей ефірів еритроміцину і ЛФ, забезпечених кислотостійкими кишковорозчинними оболонками. Це дозволило збільшити біодоступність еритроміцину більш ніж в 2 рази. При прийомі основи еритроміцину у вигляді кишковорозчинних пелет (діаметром 0,5-1,5 мм) всмоктування антибіотика більш стабільне, ніж при прийомі кишковорозчинних таблеток, і відзначаються більш високі концентрації еритроміцину в крові. Це пов'язано з тим, що пелети, на відміну від таблеток, не затримуються в пілоричному відділі шлунка. Їжа може більшою мірою знижувати абсорбцію еритроміцину з кишковорозчинних таблеток і, в меншій мірі, з пелет.
Кишковорозчинні покриття використовуються як для антибіотиків системної дії, так і для впливу на локальному рівні в просвіті кишечника, наприклад, при лікуванні кишкових інфекцій. Найбільш поширеною кишковою інфекцією є вірусний гастроентерит, але інфекції можуть бути також обумовлені бактеріями і найпростішими. Стійкі до впливу шлункового соку антибіотики є прийнятним рішенням для боротьби з бактеріальною та паразитарної інфекцією кишечника. Одним з препаратів, придатних для селективної деконтамінації кишечника від мікроміцетів роду Candida є натаміцин, представлений препаратом Пімафуцин в формі таблеток з кишковорозчинним покриттям. До його переваг можна віднести те, що натамицин практично не резорбується в кишечнику. Вивільнення АФІ в просвіті кишечника і відсутність резорбції обумовлює стабільно високу концентрацію натамицина в місці вивільнення, що обумовлює позитивні результати лікування дисбіозу кишечника з надмірним зростанням Candida spp. Кишковорозчинна оболонка таблеток вигідно відрізняє Пімафуцин від інших полієнових коштів тим, що оберігає слизові оболонки верхніх відділів травного тракту від подразнення і забезпечує стабільність препарату при зберіганні. Профіль безпеки препарату надає можливості більш безпечного лікування, що застосовується до вагітних, що годують і новонародженим.
Пероральні ЛФ з кишковорозчинними покриттями використовуються і для лікування хронічного панкреатиту - групи хронічних захворювань підшлункової залози (ПЖ) різної етіології, переважно запальної природи. При прийомі антисекреторних засобів (Н2-блокатори, інгібітори протонної помпи) ефективність ферментів підвищується, оскільки їх оптимальна дія забезпечується в просвіті тонкої кишки при рН не менше 5,0. Мікротаблетірованние і мікрокапсульовані препарати панкреатину в кишковорозчинною оболонці показали високу ефективність в лікуванні екзокринної недостатності ПЖ. Прикладом може служити препарат МЕЗИМ ФОРТЕ (MenariniGroupe) в формі таблеток, вкритих кишковорозчинною оболонкою, який містить у своєму складі липазу, амілазу та протеазу і дозволяє коригувати навіть важкі порушення порожнинного травлення.
На фармацевтичному ринку присутні препарати, що застосовуються для мікробіологічної корекції дисбактеріозу кишечника, серед яких біфідо-і лактобактерії. Ці бактерії чутливі до кислого середовища, тому на світ з'явилися препарати, наприклад, БІФІ-ФОРМ (Ferrosan) і ЛІНЕКС (Lek) в формі капсул, стійких до шлункового соку, що дозволяють гарантовано доставляти бактерії в кишечник, що робить терапію захворювань надійнішою. Необхідно відзначити, що розробка капсул з кишковорозчинним покриттям ускладнюється за рахунок ряду аспектів. З точки зору технологічної реалізації, процес нанесення кишково оболонки на капсули складніше, ніж на таблетки. Щільність капсул повинна бути такою, щоб капсула при прийомі не перебувала на поверхні шлункового вмісту (що може значно продовжити її перебування в шлунку), а щодо безперешкодно проходила по шлунково-кишкового тракту далі. З цією ж метою розмір капсули повинен бути якомога менше.
На сьогоднішній день широкого поширення набули полівітамінні і полімінеральні лікарські препарати. При цьому різноманіття хімічних речовин може призводити до хімічної несумісності інгредієнтів в одній ЛФ і в організмі людини. У таких випадках використання кишковорозчинних покриттів може представляти інтерес як інструмент для диференціації місць вивільнення АФІ, за допомогою якого можна уникнути хімічної взаємодії речовин між собою, взаємодії з кислим середовищем шлунка і конкуренції за місця зв'язування в організмі людини. Прикладом використання кишковорозчинними покриття може служити препарат ГЕМСІНЕРАЛ-ТД (USVLimited) в формі капсул, наповнених пелетами заліза фумарату, ціанокобаламіну і фолієвої кислоти.
В даній статті наведено побіжний огляд використання кишковорозчинних покриттів, який на конкретних випадках демонструє переваги їх використання. Існуючі технології виробництва, високотехнологічне обладнання та широкий вибір допоміжних речовин дозволяють фармацевтичним компаніям здійснювати серійне виробництво препаратів різних ATCклассов з pH-залежним вивільненням АФІ і надійним відтворенням якісних характеристик. Використання кишечнорастворимой оболонки дозволяє в ряді випадків забезпечити стабільність АФІ при проходженні шлунка, оптимізувати споживчі якості лікарського засобу та поліпшити профіль ефективності та безпеки препарату.