Періодичний закон і періодична система елементів.
Електронні сімейства елементів і їх розташування в періодичній системі Д.І. Менделєєва.
Періодична зміна властивостей елементів і їх сполук.
ПЕРІОДИЧНИЙ ЗАКОН І ПЕРІОДИЧНА СИСТЕМА ЕЛЕМЕНТІВ.
Періодичний закон був відкритий Менделєєвим в 1869 році. Закон встановлював залежність між властивостями елемента і атомним вагою. З розвитком квантової механіки періодичний закон отримав суворе теоретичне обгрунтування і нове формулювання.
Властивості простих речовин, а так само форми і властивості з'єднань знаходиться в періодичній залежності від величини зарядів ядер їх атомів.
Графічне відображення періодичного закону Д. І. Менделєєва називається періодичною системою елементів.
Структура періодичної системи.
Періодична система елементів складається з періодів, груп і підгруп. Періодом називається послідовний ряд елементів, розміщених в порядку зростання заряду ядра атомів, електронна конфігурація яких змінюється від ns 1 доns 2 p 6 (іліns 2 у першого періоду). Періоди починаються сs-елементів та заканчіваютсяp-елементом. (У першого періоду -s-елементом). Малі періоди містять 2 і 8 елементів, великі періоди - 18 і 32 елемента, сьомий період залишається незавершеним.
Групи - це вертикальні ряди елементів, що мають однакову конфігурацію валентних електронів. Розрізняють головні (А) підгрупи і побічні (В) підгрупи. Елементи, розташовані в одній і тій же групі мають однакову конфігурацією валентних електронів, отже, мають подібні хімічні властивості. Їх називають "елементи-аналоги".
Розглянемо зв'язок між становищем елемента в періодичній системі і електронною будовою його атомів.
ЕЛЕКТРОННІ РОДИНИ ЕЛЕМЕНТІВ ТА ЇХ РОЗТАШУВАННЯ У ПЕРІОДИЧНОЇ СИСТЕМІ Д.І. Менделєєва.
Залежно від того, кокой енергетичний підрівень заповнюється останнім, розрізняють 4 електронних сімейства елементів: s, p, dіf, які займають певне положення в періодичній системі елементів.
1. s-Елементи - сімейство елементів, у яких при заповненні електронних рівнів електронами, останній електрон йде на внешнійs-підрівень. Вони знаходяться в першій групі головної підгрупи і в другій групі головної підгрупи (до них також относітсяHe). Максимальне число електронів наs-підрівні дорівнює двом, тому в кожному періоді по дваs-елемента, і на зовнішньому енергетичному рівні у них 1 або 2 електрони.
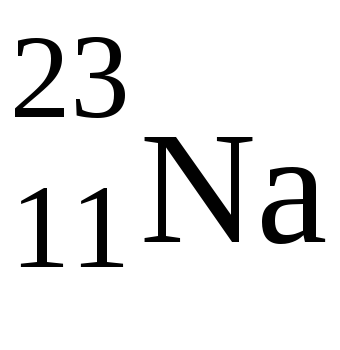
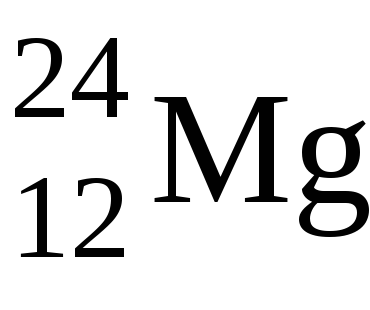
В цьому випадку валентними будуть s-електрони, відповідно один електрон у атомаNa і 2 електрона у атомаMg.
2. У p-елементів останній електрон йде наp-підрівень зовнішнього рівня. Ці елементи розташовані сIIIпоVIIIгруппу головної підгрупи кожного періоду. Їх число в періоді дорівнює 6, тому що максимальне число електронів наp-підрівні дорівнює 6.
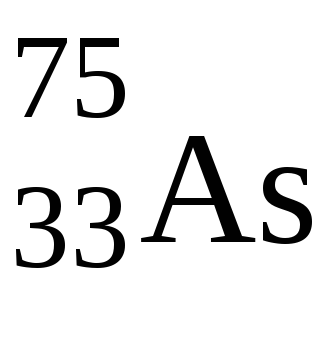
В цьому випадку валентні електрони мають конфігурацію 4s 2 p 3. поетомуAsможет проявляти ступінь окислення від -3 до +5. Характерними ступенями окислення для нього є -3, +3, +5.
3. Уd-елементів спочатку заполняетсяs-підрівень зовнішнього рівня, а останній електрон йде наd-підрівень предвнешнего уровня.d-Елементи знаходяться в побічних підгрупах періодичної системи. Уd-елементів можливий проскакування електронів сs-підрівні зовнішнього рівня на свободнуюd-орбіталь предвнешнего рівня, якщо це енергетично вигідно. У цих елементів на зовнішньому рівні 1 або 2 електрони. УPdнаблюдается подвійний перескок, у нього на зовнішньому рівні немає електронів.
Максимальне число електронів на d-підрівні дорівнює 10, тому починаючи з 4-го періоду в кожному періоді по 10d-елементів.
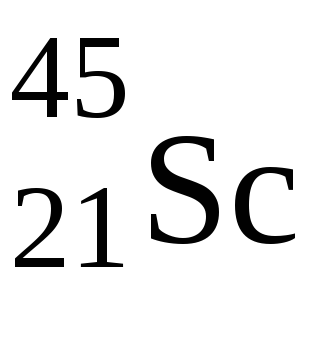
У цьому випадку спочатку заповнюється 4s-підрівень, і тільки потім 3d-підрівень. У цього елемента валентні електрони мають конфігурацію 3d 1 4s 2. поетомуScімеет характерну ступінь окислення +3.
4. f-Елементами називаються елементи, у яких при заповненні електронних рівнів, останній електрон йде наf-підрівень предпредвнешнего рівня. До них відносяться лантаноїди і актиноїди.
Максимальне число електронів на f-підрівні дорівнює 14, тому в 6 і 7 періодах періодичної системи по 14f-елементів.
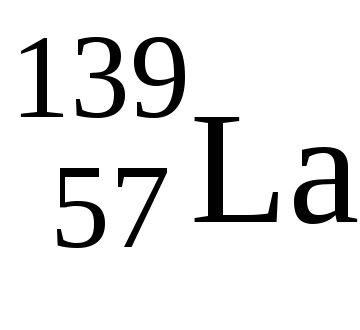
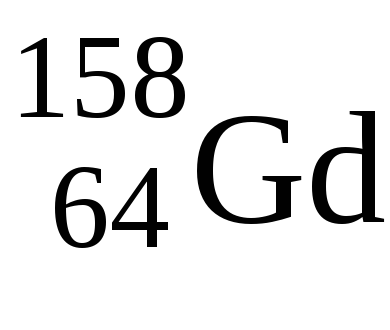
У Laвалентние електрони мають конфігурацію 5d 1 6s 2 - тіпічнийd-елемент, уGdконфігурація валентних електронів також 5d 1 6s 2. тільки потім заповнюється 4f-підрівень, тому в обох елементів ступінь окислення +3.
Періодичної зміни властивостей ЕЛЕМЕНТІВ ТА ЇХ СПОЛУК.
Відповідно до сучасних формулювань періодичного закону властивості елементів перебувають у періодичній залежності від заряду ядра всіх атомів.
Розглянемо деякі характеристики елементів.
Внаслідок хвильової природи електрона, атом не має різко окреслених меж, тому поняття про розмір атома не є строгим і існує кілька методів визначення радіуса атома. В даний час для всіх елементів з металевої і ковалентним зв'язком рекомендується застосовувати орбітальні радіуси. Орбітальні радіуси. - це відстань від ядра атома до максимуму функції радіального розподілу ймовірності останньої атомної орбіталі, заселеної електронами. Наприклад, для атома міді - це відстань від ядра атома до максимуму електронної щільності 4s-орбіталі.
Залежність атомних радіусів від заряду ядра атома має періодичний характер (Рис. 12.)
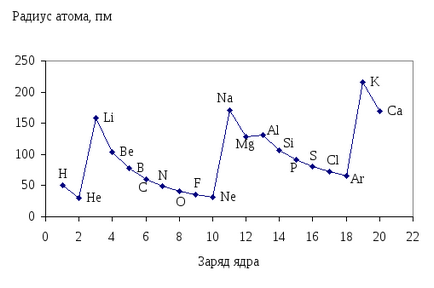
Мал. 12. Залежність орбітальних радіусів атомів від порядкового номера елементів.
В межах періоду зі збільшенням порядкового номера елемента розмір атома зменшується, так як збільшується заряд ядра, а кількість енергетичних рівнів залишається постійним. Чим більше заряд ядра, тим сильніше електрони притягуються до ядра, що призводить до зменшення розмірів атома. Особливо чітко це спостерігається у IIіIIIперіодах.
Орбітальні радіуси атомів елементів IIіIIIперіодов (пм).
Така закономірність пояснюється збільшенням числа електронних оболонок і зростаючим видаленням зовнішніх електронів від ядра.
2. Енергія іонізації.
Енергією іонізації називається енергія, необхідна для видалення електрона з атома, іона або молекули в газовій фазі пріT = 0 До без передачі звільненому електрону кінетичної енергії. Позначають енергію іонізації сімволомНіон і виражається в кДж, Дж або еВ.
1 еВ - енергія, яку набуває електрон в ускоряющем електричному полі з різницею потенціалів 1 В (1еВ = 96,5 кДж)
Енергія іонізації, виражена в електронвольтах чисельно дорівнює потенціалу іонізації атомів, вираженого в вольтах.
Потенціалом іонізації атомів даного елемента називається найменша напруга поля, при якому швидкість електронів стає достатньою для іонізації атомів. Кожен наступний електрон відривається важче, тобто Н1 <Н2 <Н3 <…<Нn .
Величина Ніон характеризує здатність елемента віддавати електрони, тобто характеризує його відновні властивості. Чим меньшеНіон. тим вище відновні властивості елементів. На рис. 13.показана залежність першої енергії іонізації атомів елементовI-IIIперіодов від зарядів ядер їх атомів.
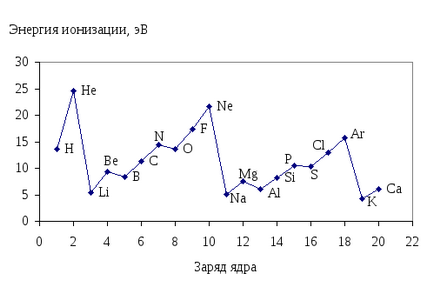
Мал. 13. Залежність першої енергії іонізації атомів елементів I-IIIперіодов від зарядів ядер їх атомів.
Порівняння даних, представлених на рис. 13показивает, що велічінаНіон знаходиться в періодичній залежності від зарядів ядер атомів елементів.
В межах періоду зі збільшенням заряду ядра атома енергія іонізації збільшується, а в межах групи - зменшується.
Перші енергії іонізації атомів елементів IAіIIA груп, еВ.
Найсильнішим відновником є Fr.
3. Енергія спорідненості до електронів - енергія, яка виділяється при приєднанні електронів до порушеної атома, іона або радикалу.
Ця енергія характеризує окислювальні властивості елемента, тобто здатність приєднувати електрони.
У періоді зі збільшенням заряду ядра атома енергія збільшується, а в межах групи - зменшується, тому що збільшується радіус атома. Таким чином, чим більше спорідненість до електрона, тим сильнішим окислювачем є елемент. Найсильнішим окислювачем є F.
Щоб визначити, які властивості найбільш характерні для даного елемента, визначимо електронний торгівельний:
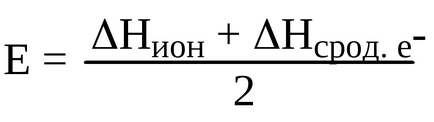
За визначенням Л. Полінга електронегативність - це здатність атомів в молекулі або складному йоні притягувати до себе електрони, які беруть участь в утворенні зв'язків, тобто по Л. Полингу, електротріцательность відноситься до атомам, пов'язаним в молекулу. Полінг ввів відносну шкалу електронегативності, прийнявши ЕО фтору, рівну 4. У періоді електронний торгівельний зі збільшенням заряду ядра атомів збільшується, а в межах групи - зменшується.
Електронегативність елементів IIіIIIперіодов по Полингу (в відносних одиницях)
Згідно з формулюванням періодичного закону, періодично змінюються не тільки властивості елементів, а й властивості їх сполук по класах: оксидів, гідроксидів, водневих з'єднань.
Наприклад, кислотні та основні властивості оксидів і гідроксидів змінюються в залежності від зміни заряду ядер атомів елементів.
У періоді, при збільшенні заряду ядра атомів, основні властивості оксидів і гідроксидів зменшуються, а кислотні збільшуються. Візьмемо, наприклад, IIIперіод:
NaOH- серйозна причина
Mg (OH) 2 - погано розчинна підставу
Al (OH) 3 - амфотерний гідроксид
H2 SiO3 - слабка кислота
H3 PO4 - кислота середньої сили
H2 SO4 - сильна кислота
HClO4 - дуже сильна кислота
У групах із збільшенням заряду ядра атомів основні властивості оксидів і гідроксидів посилюються, а кислотні слабшають. Наприклад, розглянемо IVA групу:
H2 SO4 - дуже слабка кислота
H2 GeO3 Ge (OH) 4 - амфотерний гідроксид з переважанням кислотних властивостей
Pb (OH) 4 - амфотерний гідроксид з переважанням основних властивостей
Всі хімічні сполуки утворюються за рахунок взаємодії атомів, в результаті яких лежить хімічний зв'язок.