З розгляду механізму горіння твер-дого та рідкого палива слід, що загальна швидкість горіння визначається не тільки ско-ростью власне хімічних реакцій, але і підведенням кисню до зони реагування за рахунок турбулентної та молекулярної дифузії. Для розрахунку цього комплексного процесу ис-товують наступну модель горіння (рис. 4.7).
Палаюча частка вважається оточеній прикордонної плівкою, в межах якої про-виходить Догорание окису вуглецю, а перекіс речовини здійснюється тільки за рахунок мо-лекулярной дифузії. В межах плівки відбувається зміна концентрацій речовин і температури. За її межами в основному потоці, що оточує частку, має місце інтенсивний турбулентний массоперенос. У зв'язку з цим основний потік вважається од-нородного, і в ньому відсутні градієнти температур і концентрацій. В результаті можна прийняти, що концентрації кисню в обсязі основного потоку З ^ і на поверх-
Ності прикордонної плівки рівні.
Кількість кисню, що дифундує через прикордонну плівку до одиниці поверх-ності частки, визначається законом Фіка
Де пекло = £) / 6 коефіцієнт масообміну, ха-рактерізует швидкість перенесення речовини крізь шар товщиною б, м / с; D - коефі-цієнт молекулярної дифузії, м2 / с.
Максимальний підведення кисню до поверх-ності через прикордонний шар буде наблю-датися, якщо С ™ = 0. Тоді
Приймемо для спрощення рішення задачі умова, що весь дифундує кисень реагує на поверхні частинки. Тоді ско-кість хімічної реакції на одиниці поверх-ності, яка визначається по витраті кисню, виражається згідно (4.5)
Максимальна швидкість реагування матиме місце, коли = С ° Гf:
На рис. 4.8 показаний характер зміни максимальних значень швидкості (К) макс і
До _____________ у W) 6
Яд + k - "прЬо, -
За своєю структурою вираз (4.17) по-добно звичайному кінетичного рівняння, в якому константа швидкості реакції k за-менена наведеним коефіцієнтом КЩ. ко-торий враховує як реакційні властивості пального, так і умови достазкі окислювача до поверхні реагування.
Якщо дифузний массообмен відноси-кові слабо залежить від температури (ад.- '-'Г0'5), то швидкість хімічної реакції на
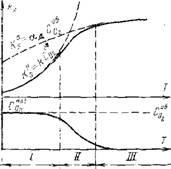
Нання максимальних швидкостей диффузионно-го підведення кисню до поверхні і скоро-сті його поглинання на ній (рис. 4.8) позво-ляет виділити дві основні області горіння коксових частинок. При відносно невисоких температурах (для коксових частинок менше 1000 ° С) реакція на поверхні протікає досить повільно, і споживання кислоро-й у багато разів менше можливості його до-ставки до поверхні, т. Е. K Чаї kmp ^ sJi і C0i І загальна швидкість реакції обмежена кине-тикой хімічного реагування на поверх-ності. Ця температурна область реакцій називається кінетичної областю горіння. Тут процес горіння не залежить від умов підведення кисню. При високих температурах процесу (ви-ше 1400 ° С) за рахунок свого швидкого віку-ня константа швидкості реакції на поверхно-сті значно перевершує максимальну швидкість надходження кисню до поверхно-сти, яка слабо змінюється з температу-рій. Тоді і загальна швидкість реакції визначається умовою підведення кисню У цій зоні, незважаючи на зростання температу-ри, швидкість реакції змінюється повільно. Доставляється дифузією до поверхні киць-лород миттєво вступає в реакцію, в ре-док чого його концентрація у поверхні стає практично рівною нулю. Ре-акція могла б йти зі значно більшою швидкістю, але вона стримується недостаточ-ним підведенням кисню. Ця температурна область реакції називається дифузійної областю горіння. В умовах браку киць-лорода у поверхні отримує розвиток ре-акція відновлення СОГ до СО на Раска-ленній поверхні вуглецю, а діффунді-ючий кисень повністю перехоплюється в прикордонній плівці газоподібним СО, де і відбувається окислення до двоокису вуглецю СОГ. У цій області швидкість горіння увеличи-ється з ростом швидкості обдування частинок і зменшенням їх розміру. У зоні проміжних температур (3000- 1400 ° С) швидкість хімічної реакції на по-поверхні стає сумірною з скоро-стю доставки кисню і тоді загальна швидкість реакції визначається обома процесу-ми. Ця зона називається проміжною об-областю горіння. Її розташування за шкалою ^ Омера коксових ча - розмір частки, тим при високій температурі починається пере-вихідна область. Займання будь-якого палива починає-ся при відносно низьких температурах і в умовах достатньої кількості кислоро-да, т. Е. В кінетичної області. У міру збіль-личен температури швидко зростає витрата кисню в зоні реакції і процес через проміжну область переходить в дифузії-онную. Завершення горіння зазвичай знаходиться в глибоко дифузійної області, коли оста-точні концентрації окислювача виявляються досить низькими, що значно гальмує вигоряння залишився палива [72].Схожі статті