Інсуліновий рецептор (IR) (англ. Insulin receptor) - трансмембранний рецептор. який активується інсуліном. IGF-I. IGF-II і належить до великого класу тірозінкіназная рецепторів [1]. Метаболічно, інсуліновий рецептор грає ключову роль в регуляції гомеостазу глюкози, функціонального процесу, який при дегенеративних умовах може привести до ряду клінічних проявів, в тому числі діабету і раку [2] [3]. Біохімічно інсуліновий рецептор кодується одним геном INSR, альтернативний сплайсинг якого в ході транскрипції виробляє або до IR-A або до IR-B ізоформами [4]. Наступні Посттрансляційні події кожної ізоформи призводять до формування протеолітичних розщеплених α і β-субодиниць, які при об'єднанні, в кінцевому рахунку здатні до димеризации з отриманням Дисульфідні пов'язаного трансмембранного інсулінового рецептора масою ≈ 320 кДа [4].
Спочатку транскрипти альтернативних варіантів сплайсингу гена INSR транслюються з утворенням одного з двох мономірних ізомерів: IR-A, в якому вирізаний екзон 11, і IR-B, в якому є екзон 11. Включення екзона 11 призводить до додавання 12 амінокислот вище фурину в сайті протеолітичного розщеплення.

Схема кольорового кодування інсулінового рецептора
При димеризации рецептора, після протеолітичного розщеплення α- і β-ланцюгів, додаткові 12 амінокислот залишаються на С-кінці α-ланцюга (позначеної αCT), де вони імовірно впливають на взаємодії рецептора і ліганда [5].
Кожен ізомеріческій мономер структурно розбитий на 8 різних доменів; домен лейцин-збагачених повторів (L1, залишки 1-157), регіон багатий цистеїном (CR, залишки 158-310), додатковий домен лейцин-збагачених повторів (L2, залишки 311-470), три типи доменів фибронектина III; FnIII-1 (залишки 471-595), FnIII-2 (залишки 596-808) і FnIII-3 (залишки 809-906). Крім того, вставною домен (ID, залишки 638-756) знаходиться в межах FnIII-2, що містить сайт розщеплення α / β фурину, протеоліз якого діють як в IDα так і IDβ доменах. У β-ланцюга, нижче області FnIII-3 знаходиться трансмембранная спіраль і внутрішньоклітинна околомембранная область, безпосередньо вище внутрішньоклітинного каталітичного тірозінкіназной домену, відповідального за активацію внутрішньоклітинних сигнальних шляхів [6]. При розщепленні мономера на відповідні α і β ланцюга, рецептор гомо- чи гетеродімерізуется через ковалентно дисульфидную зв'язок, а між мономерами в димере утворюється дві дисульфідні зв'язки, що йдуть від кожного α-ланцюга. Загальна структура 3D ектодомена [en]. володіє чотирма сайтами зв'язування ліганда, нагадує перевернуту V. Кожен мономер повертається приблизно 2 рази навколо осі, що проходить паралельно перевернутої V. L2 і FnIII-1 доменів від кожного мономера, що формує вершину перевернутої V [6] [7].
Ендогенні ліганди інсулінового рецептора включають інсулін. IGF-I і IGF-II. Зв'язування ліганда з α-ланцюгами ектодомена IR викликає структурні зміни в рецепторі, що ведуть до автофосфорілірованію різних залишків тирозину у внутрішньоклітинному домені TK в β-ланцюга. Ці зміни способствовуют рекрутування певних адаптерних білків [en]. таких як білки субстрату інсулінового рецептора (IRS) на додаток до SH2-B [en] (гомолог Src 2 - B), APS і протєїнфосфатаза, таких як PTP1B [en]. в кінцевому підсумку, сприяють подальшим процесам, пов'язаним з гомеостазом глюкози в крові [8].
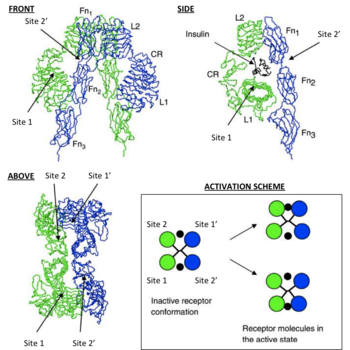
Схема, яка зображує можливі сайти зв'язування IR
Строго кажучи, відносини між інсуліновим рецептором і лігандом показують складні аллостерічеськіє властивості. На це вказує графік Скетчарда [en] який показує, що виміряний співвідношення інсулінового рецептора, пов'язаного з лігандом, щодо незв'язаного лиганда не слід лінійної залежності щодо змін концентрації інсулінового рецептора, пов'язаного з лігандом, даючи підставу припустити, що інсуліновий рецептор і його ліганд взаємодіють з механізму кооперативно пов'язані [en] [9]. Крім того, спостереження, що швидкість дисоціації IR-ліганда збільшується при додаванні незв'язаного лиганда передбачає, що природа цієї співпраці негативна; інакше кажучи, початкова зв'язування ліганда з IR інгібує додаткове зв'язування зі своїм другим активним сайтом, демонструючи аллостеріческого інгібування [9].
Хоча точний механізм скріплення IR з його лігандом структурно ще не з'ясований, з точки зору системної біології. біологічно значуща пророкування кінетики [en] IR-ліганд (інсулін / IGF-I) було визначено в контексті доступною зараз структури ектодомена IR [6] [7].
Ці моделі стверджують, що кожен мономер IR має 2 інсулінових сайту зв'язування; Сайт 1, який зв'язується з «класичною» поверхнею зв'язування інсуліну. що складається з L1 плюс αCT доменів і сайту 2, що складається з петель на стику FnIII-1 і FnIII-2, за прогнозами, зв'язуються з «новим» гексамерним особою сайту зв'язування інсуліну [1]. Так як кожен мономер надає IR ектодомену уявлення 3D «дзеркальної» взаємодоповнюваності, N-термінальний сайт 1 з одного мономера, в кінцевому рахунку стикається з C-термінальним сайтом 2 другого мономера, що також вірно для кожного дзеркального доповнення мономерів (протилежна сторона структури ектодомена) . Поточна література відрізняє сайти зв'язування доповнень, призначивши на сайті 1 і 2 мономерні сайти доповнень, як 3 і 4 або як сайт 1 'і 2' відповідно [1] [10].
Таким чином, ці моделі стверджують, що кожен IR може зв'язуватися з молекулою інсуліну (який має дві зв'язують поверхні) в 4 місцях, за допомогою сайтів 1, 2, (3/1 ') або (4/2'). Оскільки кожен сайт 1 проксимально стикається з сайтом 2, за прогнозами, відбудеться зв'язування інсуліну конкретним сайтом, «зшивання» [en] за допомогою лиганда між мономерами, (тобто [мономер 1 Сайт 1 - Інсулін - мономер 2 сайт (4/2 ' )] або [мономер 1 сайт 2 - Інсулін - мономер 2-сайт (3/1 ')]). Відповідно до чинного математичним моделюванням IR-інсулінової кінетики, є два важливих наслідки для подій зшивання інсуліну; 1. в вищезгаданому спостереженні негативне взаємодія IR і його ліганда, після зв'язування ліганда з IR знижується і 2. фізичний вплив призводить до зшивання ектодомена в такий конформації, яка необхідна для настання подій внутрішньоклітинного фосфорилювання тирозину (тобто ці події служать вимогою до активації рецептора з подальшим підтриманням гомеостазу глюкози в крові) [8].
Рецептори тирозинкінази [en]. в тому числі інсуліновий рецептор, опосередковують свою активність, викликаючи додавання фосфатної групи до конкретних тирозину в клітинах певних білків. У «підкладці» білки, які фосфорилюються інсуліновим рецептором включає білок, званий «IRS-1» для «інсулінового рецептора підкладки 1». Зв'язування і фосфорилювання IRS-1 в кінцевому підсумку призводить до збільшення високого спорідненості молекул транспортера глюкози (GLUT4) на зовнішній мембрані інсуліночутливості тканин, в тому числі м'язових клітин і жирової тканини. і, отже, до збільшення поглинання глюкози з крові в цих тканинах. Іншими словами, глюкозний транспортер GLUT4 транспортується з клітинних везикул до клітинної поверхні, де він потім може опосередковувати транспорт глюкози в клітину.
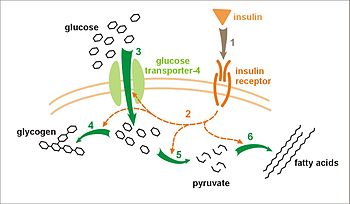
Вплив інсуліну на поглинання і метаболізм глюкози. Інсулін зв'язується зі своїм рецептором (1), який, в свою чергу, запускає кілька каскадів активації протеїну (2). До них відносяться: транслокации Glut-4 транспортера до плазматичної мембрани і приплив глюкози (3), синтез глікогену (4), гліколіз (5), синтез жирних кислот (6).
Основна діяльність активації інсулінового рецептора - індукувати поглинання глюкози. З цієї причини «нечутливість інсуліну», або зниження сигналізації інсулінового рецептора, призводить до цукрового діабету 2 типу - клітини не здатні прийняти глюкозу і в результаті - гіперглікемія (підвищення циркуляції глюкози) і всі наслідки діабету.
Кілька пацієнтів з гомозиготною мутацією гена INSR були описані, як отримали синдром Донохью [en]. Це аутосомно-рецесивні порушення роблять абсолютно нефункціональними інсулінові рецептори. Ці пацієнти мають низькорозташованим, часто опуклі, вуха, ніздрі, потовщені губи і сильну затримку росту. У більшості випадків, прогноз для цих пацієнтів є вкрай бідним, смертельний результат трапляється протягом першого року життя. Інші мутації того ж гена викликають менш важкий синдром Робсона-Менденхолл [en]. при яких пацієнти мають характерно аномальні зуби, гіпертрофовані ясна і розширення шишкоподібної залози. Обидва захворювання представляють флуктації рівня глюкози: після прийому їжі глюкоза спочатку дуже висока, а потім різко падає до аномально низьких рівнів [11].
Регуляція експресії генів
Активовані IRS-1 діють в якості вторинного месенджера в клітці, щоб стимулювати транскрипцію інсулінорегуліруемих генів. По-перше, білок Grb2 пов'язує Р-Tyr залишок IRS-1 в його домені SH2 [en]. Grb2 стає в змозі зв'язати SOS, який в свою чергу каталізує заміну пов'язаного GDP з GTP в Ras, G-білка. Цей білок потім починає каскад фосфорилювання, що призводить до активації мітогеноактівіруемой протеїнкінази (МАРК), яка входить в ядро і фосфорилирует різні фактори ядерної транскрипції (наприклад, Elk1).
Стимуляція синтезу глікогену
Синтез глікогену також стимулюється інсуліновим рецептором за допомогою IRS-1. У цьому випадку, це SH2-домен [en] з кінази PI-3 (PI-3K [en]), який пов'язує P-Tyr з IRS-1. Тепер активації PI-3K може конвертувати мембранні ліпідні фосфатидилинозитол 4,5-бісфосфат [en] (PIP2) до фосфатіділінозіт 3,4,5-трифосфату [en] (PIP3). Це побічно активація протеїн PKB (Akt) за допомогою фосфорилювання. РКВ потім фосфорилирует кілька цільових білків, в тому числі киназу глікогенсінтази 3 [en] (GSK-3). GSK-3 несе відповідальність за фосфорилирование (і, отже, деактивацію) глікогенсінтази. Коли GSK-3 фосфорилируется, він відключається, і запобігає деактивації глікогенсінтази. Цим обхідним шляхом інсулін збільшує синтез глікогену.
Після того як молекула інсуліну стикується з рецептором і активує його, вона може бути випущена назад в позаклітинне середовище, або може бути деградована в клітці. Деградація зазвичай включає ендоцитоз инсулино-рецепторного комплексу з подальшим дією ферменту, що руйнує інсулін. Більшість молекул інсуліну деградують в клітинах печінки. Було підраховано, що типова молекула інсуліну деградує приблизно через 71 хвилину після початкового випуску в кровотік [12].