При хлоруванні бензолу надлишком хлору поряд з хлорбензол утворюються дихлор- і поліхлорбензоли. Ізомерний склад поліхлорбензолов, як видно з наведеної схеми, дуже різноманітний.
При дії активних кислот Льюїса ізомеризація полегшується. Для отримання індивідуальних сполук дуже важливий підбір каталізатора.
Поліхлорбензоли служать вихідною сировиною в синтезі полі- і перфторпроізводних, які є интермедиатами при отриманні антибіотиків фторхінолонового ряду. Глибоке хлорування суміші три- і тетрахлорбензол при температурі 100 ° С дає пента- і гексахлорбензол.
При обробці п-хлорфторбензола хлороводородом в присутності хлориду алюмінію утворюється суміш ізомерних продуктів:
У наведеному прикладі спостерігається зміщення тільки атома хлору, але не фтору, т. К. Енергія зв'язку C-F істотно вище, ніж зв'язку C-Cl.
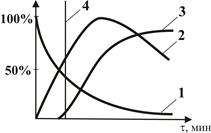
У тих випадках, коли необхідно запобігти утворенню поліхлорпроізводних, застосовують такий технологічний прийом, як обрив реакції на початкових стадіях процесу. Кінетичні криві наведені на рис. 2.2.
Мал. 2.2. Кінетичні криві реакції хлорування бензолу:
1-крива витрати бензолу в часі від 100% до 0%; 2 - крива освіти
хлорбензолу; 3 - крива отримання дихлорбензол; 4 - обрив реакції
З рис. 2.2 видно, що зі збільшенням маси хлорбензолу починається утворення дихлорбензол, концентрація хлорбензолу знижується. Для того щоб зменшити ймовірність утворення ди- і поліхлорбензолов, необхідно обірвати реакцію на початковій стадії. Бензол залишається невитраченим, домішка дихлорбензол мінімальна.
При хлоруванні толуолу утворюється суміш приблизно рівних кількостей о- і п-хлортолуолов з домішкою діхлорпроізводних. При цьому до 70% толуолу НЕ хлорується і залишається в незміненому вигляді. Ізомери розділяють дробової кристалізацією. Вихідним продуктом в синтезі мефенаміновою кислоти служить о- хлорбензойная кислота, яку синтезують з о- хлортолуола.
Для синтезу лікарських препаратів необхідно використовувати індивідуальні з'єднання високої чистоти. Тому 2,4-діхлортолуол, що є проміжним продуктом у виробництві аміназину, отримують диазотировании 2,4-толуілендіамін і заміною діазоніевой груп на хлор (див. Розділ 2.4). Звичайно, це з'єднання, синтезоване прямим хлоруванням толуолу, набагато дешевше, проте містить незначні домішки інших ізомерів.
При наявності в ароматичному ядрі електроноакцепторні заступника регіоселективність процесу збільшується, т. К. Загальна швидкість реакції хлорування зменшується.
У виробництві гипотиазида використовують м- хлоранилин, який отримують з м- нітрохлорбензола. При хлоруванні нитробензола утворюється в основному м- нітрохлорбензоли. Невелика домішка м- дихлорбензола виникає в результаті ІПСОА -заміщених нітрогрупи.
Хлорування нитробензола одним з найбільш активних хлорують реагентів, яким є фторсульфонілгіпохлоріт, вже при 20 о С призводить до пентахлорнітробензолу. Тетрахлорфталевий ангідрид отримують при пропущенні хлору в розчин фталевого ангідриду в хлорсульфоновой кислоті при температурі 120 ° С протягом 50 год. В якості каталізатора в цьому процесі використовують йод.
У виробництві гіпотензивного препарату клонідин (клофелін) проміжним продуктом є 2,6-діхлоранілін. При прямому хлорування аніліну утворюється складна суміш сполук. Тому для синтезу індивідуального 2,6-діхлораніліна блокують п-положення аніліну введенням сульфогрупи, яка виконує функцію захисної угруповання.
При хлоруванні сульфаниловой кислоти утворюється тільки один продукт - 4-аміно-3,5-діхлорбензолсульфокіслота, 2,6-діхлоранілін отримують за допомогою десульфірування.
Замість сульфаниловой кислоти в якості вихідного продукту може бути використаний стрептоцид. Хлорування в цьому випадку ведуть в соляній кислоті з пероксидом водню і також видаляють сульфогруппу.
У виробництві гербіциду 2,4-Д (2,4-діхлорфеноксіуксусной кислоти) хлорування фенолу проводять в присутності води. Процес йде при низькій температурі без каталізатора, в результаті реакції утворюється в основному 2,4-діхлорфенол з домішкою 2,6-дихлор-, 2,4,6- і 2,4,5-трихлорфенолом.
Цільовий продукт відокремлюють ректифікацією, кубовий залишок не знаходить кваліфікованого застосування. Однак в кінцевому продукті - 2,4-Д, міститься незначна кількість тріхлорфеноксіуксусная кислот. При використанні цього гербіциду на полях під дією ультрафіолету спостерігається його розкладання. З домішок, а також і при утилізації кубового залишку утворюється діоксин:
Діоксин надзвичайно токсичний, викликає генетичні мутації і злоякісні новоутворення. Розлив полихлорфенолов може призвести до екологічної катастрофи. В даний час виробництво даного гербіциду заборонено. Застосування під час війни у В'єтнамі для боротьби з партизанами agent orange (гербіцид суцільної дії, тріхлорфеноксіуксусная кислота) привело до загибелі джунглів на великій площі. Крім того, серед військовослужбовців США і мирного населення відзначена висока смертність від онкологічних захворювань і народження дітей зі спадковими каліцтвами.
Цілеспрямований синтез 2,4,5-тріхлорфенола здійснюють за допомогою лужного гідролізу 1,2,4,5-тетрахлорбензол, який очищають від непрореагировавшего тетрахлорбензол, 2,3,5-тріхлорфенола та інших домішок за допомогою перекристалізації з органічних розчинників.
Вичерпне хлорування фенолу проводять спочатку при температурі 60 - 70 о С в розплаві. При цьому утворюється 2,4,6-трихлорфенол. При подальшому хлоруванні в суміші хлорсульфоновой і сірчаної кислот утворюється м'який окислювач - хлоранілу:
Хлорування фенолу в присутності хлорного заліза при 160 - 180 ° С призводить до Пентахлорфенол. В даний час його виробництво через екологічних наслідків застосування обмежена.
Промисловістю в великому обсязі випускається хлорбензол, з якого отримують 2-нітро-, 4-нітро- і 2,4-дінітрохлорбензоли. Також випускаються о- і п-хлортолуоли, що використовуються в синтезі відповідних бензойних кислот і альдегідів. Виробництво хлорфенолів знижується. У меншому обсязі виробляють 2,6-діхлоранілін і 3-нітрохлорбензоли.
Як розчинники і проміжних продуктів в ряді виробництв знаходять застосування о- і п-діхлорбензоли, які утворюються поряд з хлорбензол.
Таким чином, для отримання лікарських сполук, де потрібна висока чистота продуктів, використання хлорування на кінцевих стадіях виробництва нераціонально в зв'язку з низькою регіоселективності процесу.
Якщо хлорування широко застосовується в промисловості, то бромування використовують тільки в тих випадках, коли в препараті необхідно мати атом брому. Це ще більшою мірою відноситься до йодування. Бром і йод дуже дороги, дефіцитні і не тільки в Росії, але і у всьому світі. Основні закономірності бромирования ті ж, що і хлорування. Слід враховувати те, що бром менш сильний електрофіл, ніж хлор. Реакція більш селективна (r = - 12), що дозволяє використовувати її у виробництві 4-бром-о -ксілола, який є проміжним продуктом в синтезі 4-аміно-о -ксілола в одному з методів отримання рибофлавіну.
Через вартості брому метод дорожче, ніж виробництво 3- і 4-ксілідінов з нітроксилол при їх комплексному використанні для отримання рибофлавіну і мефенаміновою кислоти. За відсутності комплексного використання сировини бромування дає кращі результати. Здавалося б, замість бромирования можна використовувати хлорування, однак при цьому утворюється складна суміш сполук, т. К. Хлорують агенти не забезпечують селективність процесу. Бромування о- ксилолу ведуть при температурі від мінус 5 до 0 ° С, кількість брому становить 75% від розрахунку. Підвищення температури більше 5 о С призводить до утворення домішок дібромксілолов, очищення від яких скрутна, крім того, це веде до перевитрати дорогого брому. Реакційну масу промивають водою, лугом і водою, бромксілол очищають за допомогою вакуумної розгону.
Оригінальний вітчизняний противірусний препарат теброфен містить у своїй молекулі чотири атома брому:
При безпосередньому контакті теброфена з вірусом спостерігається віруліцидної дію. Препарат застосовують у вигляді мазей для лікування аденовірусної кератиту, герпесу та інших шкірних захворювань передбачуваної вірусної природи (оперізувальний лишай, простий бульбашковий і рецидивний герпес і ін.). Бромування резорцина дає 2,2 # 900;, 4,4 # 900;, 6-пентабром-1,3-бензохинон. Його нагрівання в бромбензол при 140 - 145 ° С призводить до дебромірованію і утворення подвійної С-С зв'язку між ядрами хинона. При відновленні останнього з'єднання Дитіоніти натрію отримують цільової продукт.
Синтез барвника еозин, що використовується в гістології, здійснюють за представленою схемою:
При синтезі препаратів найбільш раціонально використовувати в якості вихідних напівпродуктів бромбензол і бромтолуол.
Молекулярний йод є дуже слабким електрофілом, тому іодіруют тільки високоактивні субстрати - аміни і феноли. За відсутності електронодонорні заступників реакція йодування не йде, т. К. Кислоти Льюїса не активується молекулу йоду, на відміну від хлору і брому. В цьому випадку іодпроізводние отримують через солі діазонію. Як приклад можна розглянути препарати тироксин і трііодтіронін. Тироксин - природний гормон щитовидної залози, його застосування призводить до підвищення споживання кисню, підсилює енергетичні процеси, стимулює ріст і диференціювання тканин, покращує функціонування нервової та судинної системи, підсилює всмоктування глюкози і її утилізацію. У великих дозах знижує функцію щитовидної залози. Тироксин отримують з висушених, знежирених щитовидних залоз забійної худоби.
Трііодтіронін в 3 - 5 разів ефективніший, його дешевше отримувати одіннадцатістадійним синтезом. На останній стадії проводять йодування йодом в слабкій соляній кислоті або в оцтової кислоти:
Вихідний 3,5-дііодтіронін синтезують з відповідного діамінопроізводного (див. Розділ 2.4).
Похідні йоду затримують проходження рентгенівських променів, тому при введенні препаратів в кров на рентгенівському знімку отримують чітку картину стану судин. Таким чином, іодпроізводние є рентгеноконтрастними засобами. Синтез одного з препаратів, тріомбрасту, представлений на схемі. Іодірованіе 3,5-діамінобензойной кислоти ведуть в слабкій соляній кислоті йодистого хлором. На відміну від реакції з йодом, використання цього реагенту дає максимальну економію дефіцитного і дорогого йоду.
Трііоддіамінобензойную кислоту потім ацилуючий оцтовим ангідридом в звичайних умовах.