Всі ми користуємося милом. А чи знаєте що це таке, і як воно працює. Ось ми і вирішили «пролити» трохи хімії на ваші голови. Не лякайтеся, нічого складного. Зате багато корисного та пізнавального.

Що таке «вимити руки»? Якби все, що нас оточує, розчинялося в воді (як, наприклад, кухонна сіль), то вимити руки було б дуже легко - опустити їх в воду і почекати трохи. На жаль, велика частина речовин, до яких ми торкаємося, нерозчинні у воді, і тому, якщо вони прилипають до рук або одязі, то одна вода не дозволяє нам позбутися від цього бруду і плям. Однак можна змусити будь-яка речовина хоча б через короткий час (кілька секунд) розчинитися у воді, утворивши емульсію або суспензію - суспензія найдрібніших частинок рідкого (або твердого) речовини у воді. Цього часу часто буває досить для того, щоб потік чистої води змив емульгованих бруд, зробивши руки чистими. Мило і служить прекрасним емульгатором - хімічною сполукою, що полегшує отримання водних емульсій частинок найрізноманітніших речовин.
Як народилося мило і як його роблять зараз? При розкопках Давнього Вавилона були знайдені глиняні ємності, наповнені речовиною, схожою на мило. Написи на цих судинах говорили, що вміст зроблено при кип'ятінні жиру з попелом. Тому вважають, що варити мило вміли ще в 2800-х рр. до н.е. Записи на папірусах, залишені стародавніми єгиптянами за 1500 років до н.е. теж зберегли рецепти миловаріння з суміші тваринних і рослинних масел і попелу. Стародавні греки не знали мила, а коли милися, то спочатку терли себе глиною, піском, пемзою і попелом, потім наносили на тіло рослинне масло і зішкрібали його разом з брудом. Одяг свою вони мили без жодного мила в проточній воді.
Англійське слово soap (мило) походить від назви гори Sapo в Італії, на вершині якої, згідно з легендою, приносили тварин в жертву, вбиваючи і спалюючи їх. Дощ змивав вниз в річку Тибр, що протікає неподалік, суміш розплавленого жиру і деревного попелу. Тому глина уздовж Тибру добре милілась, що швидко оцінили жінки, прали білизну на його берегах.
До Другої світової війни мило варили кип'ятінням у воді жирних олій з лугами. Жири - це з'єднання гліцерину і органічних кислот, відомих як жирні кислоти. Під час кип'ятіння жирів з лугами утворюються гліцерин і солі жирних кислот, тобто мив. Використання мила після Другої світової війни пішло на спад, його поступово витісняли синтетичні миючі засоби. Головна причина спаду споживання мила полягала в тому, що в жорсткій воді утворювалися нерозчинні солі жирних кислот, що випадають в осад і відповідають за появу кільцевого плями у ванні і сірий відтінок білизни. Синтетичні миючі засоби (детергенти) мають такий склад, що цієї реакції не відбувається.
Що таке мило? Мило - це натрієва або калієва сіль однією з жирних кислот. Натрієві мив густіші і, як правило, тверді; калієві мив м'якші або рідкі. Молекула мила є довгий ланцюжок (хвіст), що складається з десятка і більш ланок -CH2-, з'єднаних один з одним, до одного кінця якої (голові) прикріплена карбоксильная група (-CO2). Найпростішим милом, наприклад, є стеарат натрію, який можна представити формулою NaC17H35COO (жах, правда?). де 17 атомів вуглецю з приєднаними до них атомами водню витягнуті в звивистий ланцюжок. Асиметрія молекули мила - її найважливіша властивість. Голова молекули в розчині заряджена негативно і тому притягується до позитивних полюсів диполів молекул води або, як кажуть, відчуває спорідненість до води. Інший кінець молекули мила електрично нейтральний і тому інертний по відношенню до води.
Ось так виглядає мильна молекула стеарат натрію (а) і положення іонів цих молекул на поверхні плівки води (б):
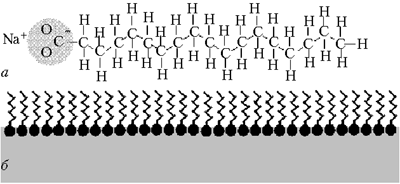
Як мило знижує поверхневий натяг? Коли мильна молекула стеарат натрію потрапляє у воду, то вона дисоціює на позитивно заряджений іон Na + і негативне підставу жирної кислоти. Негативні іони мильних молекул шикуються так, щоб з водою стикалися лише їхні голови, які відчувають до неї спорідненість. Таким чином, на поверхні води утворюється двовимірний «частокіл» мильних молекул, голови яких занурені в воду, а хвости стирчать назовні. Вимірювання показують, що молекули мила на поверхні води знижують її поверхневий натяг майже в 2,5 рази. Відбувається це через те, що, перебуваючи на поверхні води «головою вниз», вони, по-перше, не прагнуть всередину і, по-друге, відштовхуються один від одного, а не притягуються, як молекули води. Таким чином, збільшувати поверхню води, якщо в ній розчинено мило, легше. А це означає, що рідина може проникати в щілини між нитками тканини. Іншими словами, мило робить воду «більш мокрою», і «намилені» краплі води легше пролазять в проміжки між нитками тканини.
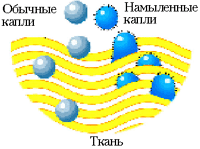
Як працює мило? Мильний розчин обволікає частинки бруду, приводячи до утворення емульсій різних забруднюючих речовин, і утримує нерозчинні частинки в стані суспензії в мильній піні і воді, які можуть бути потім видалені c очищається проточною водою. Для миючого дії важливо те, що вуглеводнева частина (хвіст) негативного іона мильною молекули нерозчинних у воді, але розчинна в жирах і маслах. Тому водорозчинна негативно заряджена голова залишається в воді, тоді як хвіст занурюється в жир. Аніони молекул з усіх боків оточують крапельки жиру і витягують їх в воду, в результаті чого утворюється суспензія крапельок жиру в воді. Так як кожна з дрібних крапельок несе на собі негативний заряд, то вони відштовхуються один від одного, а не зливаються в більш великі краплі. Цим пояснюється диспергирующий і емульгуючий ефект мильних розчинів.
Чому гаряча вода миє краще? При нагріванні середня кінетична енергія молекул води зростає, а це значить, що кожної з них потрібно менше додаткової енергії, щоб вийти на поверхню. Тому коефіцієнт поверхневого натягу води зменшується при нагріванні, і вона може проникати в найдрібніші пори і дірочки. Ось чому треба мити руки гарячою водою. Мило і детергенти ще більше знижують поверхневий натяг гарячої води.
Чому полоскати треба в холодній воді? Мета полоскання - прибрати залишки мила з випраної тканини. При пранні ми нагріваємо воду, щоб знизити поверхневий натяг води, тому мильний розчин залазить в найтонші проміжки між волокнами тканини. Щоб він виліз звідти, необхідно підвищити поверхневий натяг, і тоді кожної з сплюснутих крапельок знову стане вигідно стати кулястої, і вони вискочать з тонких проміжків між нитками. Тому полоскати тканину після прання слід в холодній воді, коли її поверхневий натяг велике.
Що таке відбілювач? У миючих засобах для прання білизни, крім власне детергенту (мила), використовують ще й відбілювач. Відбілювачі не видаляють бруд, а лише знебарвлюють її. Одні з них окислюють і тим самим руйнують деякі види забруднювачів і фарбувальних речовин. Класичним окислювачем для цих цілей служить хлор. У сучасних пральних порошках використовують більш виборчі відбілювачі на основі брому. Інші відбілювачі, звані підсилювачами білизни, роблять випрану білизну буквально «біліше білого». Для цього в пральні порошки додають флуоресцентний «безбарвний барвник», який забезпечує не тільки повне відображення видимого світла, але і часткове перетворення ультрафіолетового світла в білий або блакитний. В результаті тканина стає «сліпуче білої».