Будова і властивості атомів. Наступний після азоту представник головної підгрупи V групи Періодичної системи - елемент-неметалл фосфор Р. Атоми фосфору в порівнянні з атомами азоту мають більший радіус, менше значення електронегативності, а значить, більш виражені відновні властивості. З'єднання зі ступенем окислення -3 атома фосфору зустрічаються рідше, ніж у азоту (тільки в фосфід - з'єднаннях фосфору з металами, наприклад Са3Р2, Nа3Р). Найчастіше фосфор проявляє в з'єднаннях ступінь окислення +5. А ось його з'єднання з воднем - фосфін РН3 - той рідкісний випадок, коли ковалентний зв'язок між атомами різних елементів неполярна в силу того, що електронегативності фосфору і водню мають майже однакові значення.
Фосфор - проста речовина. Хімічний елемент фосфор утворює кілька аллотропних модифікацій. З них ви вже знаєте два простих речовини: білий фосфор і червоний фосфор.
Білий фосфор має молекулярну кристалічну решітку, що складається з молекул Р4. Не розчиняється в воді, добре розчиняється в сірковуглеці. На повітрі легко окислюється, а в порошкоподібному стані навіть запалюється.
Білий фосфор дуже отруйний. Особливою властивістю його є здатність світитися в темряві внаслідок його окислення. Зберігають його під водою.
Червоний фосфор являє собою темно-малиновий порошок. Чи не розчиняється ні у воді, ні в сероуглероде. На повітрі окислюється повільно і не займається. Неядовіт і не світиться в темряві.
При нагріванні червоного фосфору в пробірці, закритою ватним тампоном, він перетворюється в білий фосфор (концентровані пари), і якщо висмикнути тампон, білий фосфор спалахне на повітрі (рис. 35). Цей досвід показує огнеопасность білого фосфору.
Хімічні властивості червоного і білого фосфору близькі, але білий фосфор хімічно активний. Так, обидва вони, як і належить неметаллам, взаємодіють з металами. утворюючи фосфіди:
Білий фосфор самозаймається на повітрі, а червоний горить при підпалюванні. В обох випадках утворюється оксид фосфору ^), що виділяється у вигляді густого білого диму:
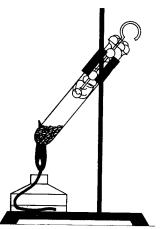
Мал. 35. Досвід, який ілюструє перехід червоного фосфору в білий
З воднем фосфор безпосередньо не реагує, фосфін РН3 можна отримати побічно, наприклад з фосфидов:
Са3Р2 + 6НСl = ЗСаСl2 + 2РН3
Фосфін - дуже отруйний газ з неприємним запахом. Легко запалюється на повітрі. Це властивість фосфіну і пояснює появу болотних блукаючих вогнів.
З'єднання фосфору. При горінні фосфіну або фосфору утворюється, як ви вже знаєте, оксид фосфору Р205 - білий гігроскопічний порошок. Це типовий кислотний оксид. володіє всіма властивостями кислотних оксидів.
Оксиду фосфору відповідає фосфорна кислота Н3Р04. Вона являє собою тверде прозоре кристалічна речовина, добре розчинна у воді в будь-яких співвідношеннях. Як триосновна кислота, Н3Р04 утворює три ряди солей:
середні солі, або фосфати, наприклад Са3 (Р04) 2, які нерозчинні в воді, крім фосфатів лужних металів;
кислі солі - дигідрофосфат, наприклад Са (Н2Р04) 2, більшість з яких добре розчиняються у воді;
кислі солі - гідрофосфат, наприклад СаНР04, які мало розчинні у воді (крім фосфатів натрію, калію і амонію), т. е. займають проміжне положення між фосфатами і гидрофосфата по розчинності.
У природі фосфор у вільному вигляді не зустрічається - тільки у вигляді сполук. Найважливішими природними сполуками фосфору є мінерали фосфорити і апатити. Основну їх масу становить фосфат кальцію Са3 (Р04) 2, з якого і отримують в промисловості фосфор.
Біологічне значення фосфору. Фосфор є постійною складовою частиною тканин організмів людини, тварин і рослин. В організмі людини більша частина фосфору пов'язана з кальцієм. Для побудови скелета дитині потрібно стільки ж фосфору, скільки і кальцію. Крім кісток, фосфор міститься в нервовій і мозкової тканинах, крові, молоці. У рослинах, як і у тварин. фосфор входить до складу білків.
З фосфору, що надходить в організм людини з їжею, головним чином з яйцями, м'ясом, молоком і хлібом, будується АТФ - аденозинтрифосфорная кислота, яка служить збирачем і носієм енергії, а також нуклеїнові кислоти - ДНК і РНК, які здійснюють передачу спадкових властивостей організму. Найбільш інтенсивно АТФ витрачається в активно працюючих органах тіла: в печінці. м'язах, мозку. Недарма знаменитий мінералог, один з основоположників науки геохімії, академік А. Е. Ферсман назвав фосфор "елементом життя і думки».
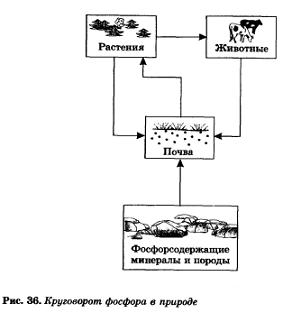
Як було зазначено, фосфор існує в природі у вигляді сполук, що містяться в грунті (або розчинених в природних водах). З грунту фосфор витягується рослинами, а тварини отримують фосфор з рослинною їжею. Після відмирання рослинних і тваринних організмів фосфор знову переходить в грунт. Так здійснюється кругообіг фосфору в природі (рис. 36).
Застосування фосфору та його сполук. Червоний фосфор використовують для виробництва сірників, фосфорної кислоти, яка, в свою чергу, йде на виробництво фосфорних добрив і кормових добавок для тваринництва. Крім того, фосфор застосовують для отримання отрутохімікатів (згадайте балончики з дихлофосом, хлорофосом і ін.).
Відкриття фосфору. Фосфор був відкритий німецьким алхіміком Г. Брандо в 1669 р і отримав свою назву за його здатність світитися в темряві (грец. Фосфор - світлоносний).
1. Аллотропия фосфору: білий фосфор, червоний фосфор.
2. Властивості фосфору: освіта фосфидов, фосфіну, оксиду фосфору (V).
3. Фосфорна кислота і три ряди її солей: фосфати, гідрофосфат і дигідрофосфат.
4. Біологічне значення фосфору (фосфат кальцію, АТФ, ДНК і РНК).
5. Застосування фосфору та його сполук.
Напишіть формули трьох видів солей натрію і фосфорної кислоти, назвіть їх і запишіть рівняння їх дисоціації.
Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
Р -> Мg3P2 -> РН3 -> Р205 -> Н3Р04 -> Са3 (Р04) 2
Використовуючи метод електронного балансу, складіть рівняння реакції, що протікає за схемою:
Р + HN03 + Н20 -> Н3Р04 + NOT
У промисловості фосфор отримують прожарювання суміші фосфату кальцію з піском і коксом відповідно до рівняння:
Са3 (Р04) 2 + 3Si02 + 5С = 3CaSi03 + 2Р + 5COt
Скільки кілограмів 80% -ної фосфорної кислоти можна отримати з 31 кг фосфору, що містить 5% домішок?
У 980 г 5% -ного розчину фосфорної кислоти розчинили 152 г оксиду фосфору (У). Який стала масова частка фосфорної кислоти в отриманому розчині?
«. Так! Це була собака, величезна, чорна, як смола. Але такого собаки ще ніхто з нас, смертних, не бачив. З її отвір пасти виривалося полум'я, очі метали іскри, по морді і загривку мерехтів переливається вогонь. Ні в чиєму запаленому мозку не могло виникнути бачення більш страшне, більш огидне, ніж це пекельне істота, вискочив на нас з туману. Страшний пес, завбільшки з молоду левицю. Його величезна паща все ще світилася блакитним полум'ям, глибоко посаджені дикі очі були обведені вогненними колами. Я доторкнувся до цієї світиться голови і, віднявши руку, побачив, що мої пальці теж засвітилися в темряві. - Фосфор, - сказав я ».
У цьому уривку зі знаменитої «Собаки Баскервілів» А. Конан-Дойл допустив суттєву хімічну помилку. Назвіть її.
Якщо у вас є виправлення або пропозиції до даного уроку, напишіть нам.
Якщо ви хочете побачити інші коригування та побажання до уроків, дивіться тут - Освітній форум.