Закон рівномірного розподілу енергії за ступенями свободи: енергія молі-ку-ли рівномірно розподіляється по сте-пе-ням волі, тобто на кожну сте-пень свободи, незалежно від кон-струк-ції молекули, доводиться однакова енергія, равнаяkT / 2.
рівняння Клаузіуса
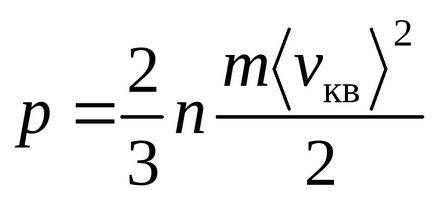
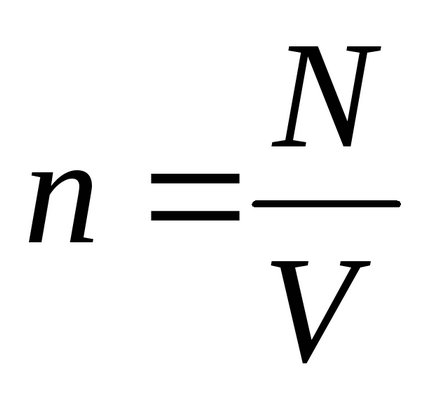

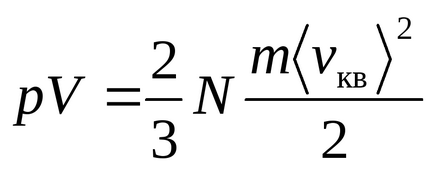
Рівняння Менделєєва - Клапейрона
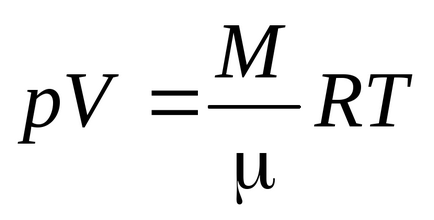

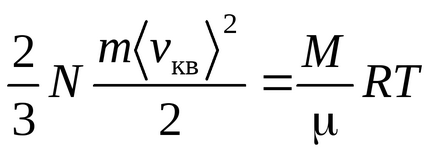

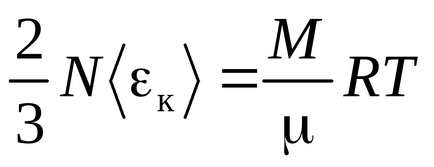

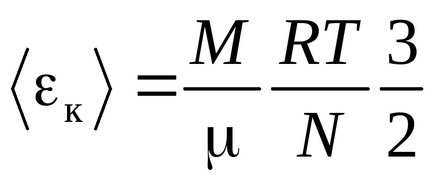
Рівняння Клаузіуса було отримано в припущенні, що молекули газу - матеріальні точки (одноатомні молекули), що мають 3 ступені свободи поступального руху. Так як всі напрямки руху рівноймовірно, повна енергія молекули порівну розподіляється між трьома ступенями свободи і на кожну ступінь свободи доводиться kT / 2 енергії
Енергія однієї молекули:
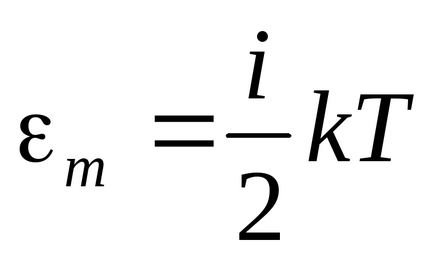
Енергія одного кіломоля:.
Енергія довільної маси газу
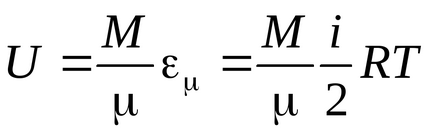
3. Робота і теплота. Теплоємність, її види.
Елементарна робота. чинена газом при переміщенні поршня на відрізок dh,
Робота, що здійснюється при кінцевому зміні обсягу газу від V1 до V2,
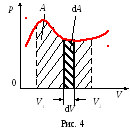
Якщо dV> 0, то dA> 0: система здійснює роботу над зовнішніми тілами - віддає їм частину своєї енергії.
якщо dV <0, то dA <0: внешние тела совершают над системой работу – система получает энергию извне.
Графічно робота зображується в координатах p і V (робоча діаграма) площею, обмеженою кривою р = f (V) і двома координатами, відповідними на-чат ко-но-му V1 і кінцевого V2 обсягами.
Передача теплової енергії (теплоти) супроводжується зміною температури тіла. Для харак-ті-рис-тики здатності тел підвищувати свою температуру за рахунок отриманого ззовні тепла вводиться поняття теплоємність.
ТеплоемкостьС- скалярна фізична величина, характе-різую-щая зв'язок між кількістю повідомленого системі тепла і зміною її температури.
види теплоємності
Повна теплоемкостьСпол чисельно дорівнює кількості тепла, яке необхідно повідомити системі, щоб підвищити її температуру на один градус
Молярна теплоемкостьС чисельно дорівнює кількості тепла, яку потрібно повідомити одному кіломолю речовини, щоб підвищити його температуру на один градус:
Питома теплоємність (с) чисельно дорівнює кількості тепла, яку потрібно повідомити одиниці маси речовини, щоб підвищити її температуру на один градус:
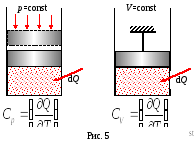
Залежно від характеру процесу розрізняють теплоємності при постійному обсязі СV і при постійному давленііСр.
Фізичний смислR- це робота розширення 1 моля ідеального газу в изобарном процесі при нагріванні його на 1 К