Мал. 5. Корозія при контакті двох металів
Вплив неоднорідності складу корозійного середовища може призводити до утворення микрогальванопара навіть на поверхні одного і того ж металу. Прикладом може служити корозія
металу під краплею води (рис.6). Так як поверхневі шари води містять більше розчиненого кисню, ніж внутрішні, поверхню металу в центрі під краплею виявляється більш активної (анодний ділянку), а на периферії краплі буде спостерігатися відновлення кисню (катодний ділянку). Після висихання краплі в її центрі з'являється досить глибоке пляма іржі.
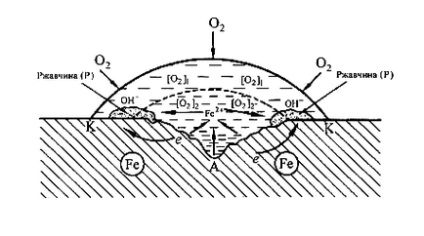
Мал. 6. Схема корозії заліза під краплею води
Подібні гальванопари виникають дуже часто при корозії побутового та промислового обладнання і в підземних спорудах, через нерівномірне аераціікіслородом окремих ділянок поверхні металу. Як приклад може служити корозія сталевої палі, закопаної в річкове дно (рис 7).
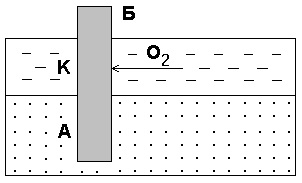
Мал. 7. Корозія в результаті нерівномірного доступу кисню. Б - паля; А - анодний ділянку; К - катодний ділянку
Частина палі, що знаходиться у воді, омивається розчиненим у ній киснем і, буде грати роль катода. Грунт практично не
містить розчиненого кисню і та частина палі, яка
знаходиться в ній, буде анодомі піддається руйнуванню.
Механічні напруги. Микрогальванопара можуть виникати при дії зовнішніх і внутрішніх механічних напружень (наприклад, вигин і провисання балки, напружені зварні шви). Корозія в цьому випадку призводить до межкристаллитному розтріскування або так званої "ножовий" корозії. Такий вид корозії виникає через те, що на розтягнутій стороні балки міжатомні зв'язку розтягнуті і слабші, ніж на верхній стороні. Енергія Гіббса на цій стороні балки дорівнює ΔG1. На стислій стороні балки енергія Гіббса має більш негативні значення ΔG2. Так як ΔG пов'язано з потенціалом ΔG = -nFЕ. то на стислій стороні маємо більш позитивний потенціалЕ2 (катод). а на розтягнутій - більш негативний потенціалЕ1 (анод).
Таким чином, механічні напруги завжди призводять до виникнення гальванопар з ЕРС = Е2- Е1. При цьому в області розтягувань спостерігається розчинення металу, а в області стиснень (катодні ділянки) відновлюється окислювач (Н + або О2).
Кінетика корозійних процесів. Є багато прикладів того, як більш активні метали розчиняються значно повільніше, ніж менш активні. Наприклад, швидкість корозії алюмінію в атмосферних умовах значно менше швидкості корозії заліза (-0,44 В), хоча електродний потенціал алюмінію більш негативний (-1,66 В). Це говорить про те, що крім впливу термодинамічних факторів на процеси корозії необхідно враховувати також і кінетичні фактори, з яких найбільш важливим є здатність металів переходити в пасивне стан.
Процес пассивации металів пов'язаний з утворенням на їх поверхні тонких плівок малорозчинних сполук - оксидів, гідроксидів, солей або їх сумішей. Ці плівки блокують поверхню і перешкоджають переносу електронів і окислювача до поверхні металу.
Відомо, що корозія металу з водневою деполяризацією
протікає тим швидше, чим менше перенапруження реакції
виділення водню (Н2, В) на ньому (див. табл. 3).
Наприклад, Е ° Pb 2+ / Pb = - 0,126 В, тобто свинець термодинамічно нестійкий в кислих середовищах, проте з розведеними сірчаної і соляної кислотами метал не взаємодіє, так як на свінцеН2 = -1,56 В.
З цієї ж причини цинк (Е ° (Zn 2+ / Zn) = -0,76 В) теж нестійкий в кислих середовищах. Однак, через велику перенапруги водню, він дуже повільно витісняє водень з кислот.
В контакті цинку з міддю (Zn | H + | Cu), наCuвосстановленіе водню протікає значно швидше (Н2 на міді на0,4 Вменьше, ніж на Zn). З цієї причини в контакті з міддю цинк розчиняється дуже активно, що супроводжується інтенсивним виділенням водню на міді.