Замовлення 320405 3 варіант 11 завдань
окремо в файлі 3 203
Що таке електронний торгівельний? Як змінюється електронегативність р - елементів в періоді і в групі періодичної системи зі збільшенням порядкового номера? Чому?
електронегативність
Електронегативні (ЕО) атома називається здатність атома в молекулі (з'єднанні) притягувати електрони, що зв'язують його з іншими атомами.
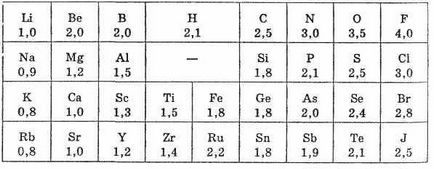
Поняття електронегативності ввів Л. Полінг (США, 1932 г.). Кількісна характеристика електронегативності атома досить умовна і не може бути виражена в одиницях будь-яких фізичних величин, тому для кількісного визначення ЕО запропоновано кілька шкал. Найбільше визнання і поширення набула шкала відносних ЕО, розроблена Л. Полингом (див. Табл. 1).
За шкалою Л. Полінга ЕО фтору (найбільш електронегативного з усіх елементів) умовно прийнята рівною 4,0; на другому місці знаходиться кисень, на третьому - азот і хлор. Водень і типові неметали знаходяться в центрі шкали; значення їх ЕО близькі до 2.
Більшість металів мають значення ЕО, приблизно рівні 1,7 або менше. Відзначимо, що ЕО є безрозмірною величиною.
Таблиця 1. Значення електронегативності елементів по Полингу
Співвідношення між різницею електронегативності і ступенем ионности зв'язку

Неважко виявити цікаву закономірність - шкала Полінга в загальних рисах нагадує періодичну систему елементів. Ця шкала дозволяє дати оцінку ступеня ионности (полярності) зв'язку. Для цього використовують залежність між різницею ЕО і ступенем ионности зв'язку (табл. 2).
З табл. 2 випливає, що чим більше різниця ЕО, тим більше ступінь ионности. Різниця ЕО, рівна 1,7, відповідає 50% - ному іонного характеру зв'язків, тому зв'язку з різницею ЕО більше 1,7 можуть вважатися іонними. Зв'язки з меншою різницею відносять до нековалентним полярним.
Для кількісної характеристики запропоновано вважати мірою електронегативності енергію, рівну арифметичній сумі енергії іонізації атома (Г) і спорідненості до електрону (E), т. Е.
де X - електронний торгівельний атома, а значить, і елемента.
Як приклад визначимо X для фтору і літію. З довідкових таблиць знайдемо, що IF = 17,42 еВ, EF = 3,62 еВ, ILi = 5,39 еВ, ELi = 0,22 еВ (обчислено непрямим шляхом).
Тоді ХF = 17,42 + 3,62 = 21,04 еВ, а ХLi = 5,39 + 0,22 = 5,61 еВ.
Фтор має найбільше значення I + E, тому він є найбільш електронегативний елементом. Найменше значення електронегативності мають атоми лужних металів.
Зазвичай електронний торгівельний літію приймають за одиницю і порівнюють з нею електронний торгівельний інших елементів. Тоді отримують прості і зручні для порівняння значення відносної електронегативності елементів (будемо її позначати через х):
xLi = 1; xF = 21,04 / 5,61 »4 і т. д.
В даний час набула широкого поширення таблиця відносних електроотріцательностей, при складанні якої використані останні дані про електронну будову атомів і їх радіусах.
Необхідно відзначити, що наведені в різних книгах по хімії значення відносної електронегативності дещо відрізняються. Це пояснюється тим, що вони розраховувалися різними методами виходячи з певних припущень і припущень.
До р - блоку відносяться 30 елементів IIIA-VIIIA груп періодичної системи і входять в другій і третій малі періоди, а також в четвертий - шостий великі періоди.
У елементів IIIA групи з'являється перший електрон на р - орбіталі. В інших групах IVA-VIIIA відбувається послідовне заповнення р - підрівні до 6 електронів. Будова зовнішніх електронних оболонок атомів елементів р - блоку ns2npa. де а = 1 ÷ 6.
У періодах зліва направо атомні та іонні радіуси р - елементів у міру збільшення заряду ядра зменшуються, енергія іонізації і спорідненість до електрону в цілому зростають, електроотріцательностьувелічівается. окислювальна активність простих речовин і неметалеві властивості посилюються.
У періоді електронний торгівельний зростає зі збільшенням порядкового номера елемента (зліва направо), а в групі. як правило, зменшується в міру збільшення заряду ядра (зверху вниз).
Строго кажучи, елементу не можна приписати постійну електронегативність. Електронегативність атома залежить від багатьох факторів, зокрема від валентного стану атома, формальної ступеня окислення, координаційного числа, природи лігандів, що становлять оточення атома в молекулярній системі, і від деяких інших.
Останнім часом все частіше для характеристики електронегативності використовують, так звану, орбітальну електронегативність, що залежить від типу атомної орбіталі, що бере участь в утворенні зв'язку, і від її електронної заселеності, т. Е. Від того, зайнята атомна орбіталь неподіленої електронної парою, одноразово заселена неспареним електроном або є вакантною.
Але, незважаючи на певні труднощі в інтерпретації і визначенні електронегативності, вона завжди залишається необхідною для якісного опису і пророкування природи зв'язків в молекулярній системі, включаючи енергію зв'язку, розподіл електричного заряду і ступінь ионности, силову постійну і т. Д.
Таким чином, найменше значення електронегативності мають s-елементи 1 групи, а найбільше р-елементи 6 і 7 груп.
завдання №23
Обчисліть тепловий ефект реакції відновлення оксиду заліза (II) воднем. виходячи з таких термодинамічних рівнянь:
FeO (к) + CO (г) = Fe (к) + CO2 (г) # 916; H = -13,18 кДж
CO (г) + 1/2 O2 = CO2 (г) # 916; H = -283,0 кДж
H2 (г) + 1 / 2O2 = H2O (г) # 916; H = -241,83 кДж
1. Тепловий ефект реакцііравен різниці сум теплот утворення продуктів і реагентів з урахуванням стехіометричних коефіцієнтів, що стоять в рівнянні.
Теплотою образованіялюбого речовини називається тепловий ефект реакцій, який утворює 1 моль складної речовини з простих, т. К. Абсолютне значення ентальпії виміряти неможливо, то в термохімії умовно теплоутворення простих речовин приймають рівним 0.
Щоб всі теплові ефекти можна було порівнювати між собою всі речовини беруть в стандартному стані (вибирається).
Газа - стан з Р = 105Па
Тверда речовина - стан, найбільш усталене кристалографічна модифікація. (C - графіт. Алмаз).
Рідина - концентрація C = 1 моль / л
Теплоти освіти речовин наводяться в довідниках.
Рівняння реакції, в якій близько символів хімічних сполук зазначаються їх агрегатні стану або кристалічна модифікація, а також значення теплових ефектів, називають термохімічними.
Для того, щоб обчислити тепловий ефект реакції відновлення оксиду заліза (II) воднем,
використовуємо наслідок закону Гесса і теплові ефекти заданих реакцій, приймаючи теплоту утворення простих речовин за 0.
з реакції
H2 (г) + 1 / 2O2 = H2O (г) # 916; H = -241,83 кДж
з реакції
Завдання № 63
Реакція йде за рівнянням N2 + O2 = 2NO. Концентрації вихідних речовин до початку реакції були: [N2] = 0,049 моль / л; [O2] = 0,01 моль / л. обчислити концентрацію цих речовин в момент. коли [NO] = 0,005 моль / л.
Залежність швидкості хімічної реакції від концентрації реагуючих речовин визначається законом діючих мас (ЗДМ).
Згідно ЗДМ швидкість реакції, що протікає в одну стадію, при постійній температурі прямо пропорційна добутку молярних концентрацій реагуючих речовин у ступенях, рівних їх стехиометрическим коефіцієнтами.
Отже, для реакції
Швидкість прямої реакції
де v - швидкість реакції
k- коефіцієнт пропорційності, який називається константою реакції
C (N2) Иc (О2) - молярні концентрації азоту і кисню
Швидкість зворотної реакції
Для обчислення концентрації реагуючих речовин складемо таблицю, для наочності та зручності обчислень
Завдання № 000
Складіть електронні рівняння і вкажіть який процес - окислення або відновлення-відбувається при наступних реакціях:
As3-®As5 + ® N3 + ®N3- S2-®S0
На підставі електронних рівнянь розставте коефіцієнти в рівнянні реакції, що йде за схемою:
Окислювально-відновні називаються реакції, що супроводжуються зміною ступеня окислення атомів, що входять до складу реагуючих речовин.
Під ступенем окислення (п) розуміють той умовний заряд атома, який обчислюється виходячи з припущення, що молекула складається тільки з іонів. Іншими словами: ступінь окислення - це той умовний заряд, який придбав би атом елемента, якщо припустити, що він прийняв або віддав ту чи іншу кількість електронів.
Окислення-відновлення - це єдиний, взаємопов'язаний процес. Окислення призводить до підвищення ступеня окислення відновлювача, а відновлення - до її зниження у окислювача.
Підвищення або зниження ступеня окислення атомів відбивається в електронних рівняннях: окислювач приймає електрони, а відновник їх віддає.
При цьому не має значення, чи переходять електрони від одного атома до іншого повністю і утворюються електронні зв'язку або електрони тільки відтягуються до більш електронегативного атома і виникає полярна зв'язок.
Про здатність тієї чи іншої речовини проявляти окислювальні, відновлювальні або подвійні (як окислювальні, так і відновні) властивості можна судити за ступенем окислення атомів окислювача і відновника.
Атом того чи іншого елемента в своїй надзвичайно окислення не може її підвищити (віддати електрони) і виявляє тільки окисні властивості. а в своїй нижчого ступеня окислення не може її знизити (прийняти електрони) і виявляє тільки восстановітельниесвойства. Атом ж елемента, що має проміжну ступінь окислення. може проявляти як окисні, так і відновні властивості.
1. Складемо електронні рівняння і вкажемо який процес - окислення або відновлення - відбувається при наступних реакціях:
процес окислення. де атом миш'яку As3- зі ступенем окислення -3 (нижча ступінь окислення для миш'яку) є відновником.
процес відновлення. де атом азоту N3 + зі ступенем окислення +3 (проміжна ступінь окислення для азоту) є окислювачем.
процес окислення. де атом сірки S2- зі ступенем окислення -2 (нижча ступінь окислення для сірки) є відновником.
2. На підставі електронних рівнянь розставимо коефіцієнти в рівнянні реакції, що йде за схемою:
S + 4 -2е = S + 6 || 3 - відновник
Mn + 7 + 3е = Mn + 4 || 2 - окислювач
З урахуванням електронних рівнянь і закону збереження мас, розставимо коефіцієнти в рівнянні
3Na2SO3 + 2KMnO4 + H2O = 3Na2SO4 + 2MnO2 + 2KOH
Завдання № 000
При якій концентрації Zn2 + (в моль / л) потенціал цинкового електрода буде на 0,015В менше його стандартного електродного потенціалу?
Якщо металеву пластинку опустити в воду, то катіони металу на її поверхні гидратируются полярними молекулами води і переходять в рідину. При цьому електрони, в надлишку залишаються в металі, заряджають його поверхневий шар негативно. Виникає електростатичне тяжіння між перейшли в рідину гідратованими катіонами і поверхнею металу. В результаті цього в системі встановлюється динамічна рівновага:
в розчині на металі
де n - число електронів, що беруть участь в процесі.
На кордоні метал - рідина виникає подвійний електричний шар, який характеризується певним стрибком потенціалу - електродним потенціалом.
Абсолютні значення електродних потенціалів виміряти не вдається.
Електродні потенціали залежать від ряду факторів (природи металу, концентрації, температури і ін.). Тому зазвичай визначають відносні електродні потенціали в певних умовах - так звані стандартні електродні потенціали (Е0).
Стандартним електродним потенціалом металу називають його електродний потенціал, що виникає при зануренні металу в розчин власного іона з концентрацією (або активністю), що дорівнює 1 моль / дм3, виміряний у порівнянні зі стандартним водневим електродом, потенціал якого при 250С умовно приймається рівним нулю (Е0 = 0 ; # 916; G0 = 0).
Маючи в своєму розпорядженні метали в ряд у міру зростання їх стандартних електродних потенціалів (Е0), отримуємо так званий ряд напруг.
Положення того чи іншого металу в ряді напруг характеризує його відновну здатність, а також окисні властивості його іонів у водних розчинах при стандартних умовах.
Чим менше значення Е0, тим більшими відновними здібностями володіє даний метал у вигляді простого речовини і тим менші окислювальні здібності виявляють його іони, і навпаки.
Електродні потенціали вимірюють в приладах, які отримали назву гальванічних елементів.
Окислювально-відновна реакція, яка характеризує роботу гальванічного елемента, протікає в напрямку, в якому ЕРС елемента має позитивне значення. В цьому випадку # 916; G0 <0, так как
Електродний потенціал металу (Е) залежить від концентрації його іонів в розчині. Ця залежність виражається рівнянням Нернста:
де - стандартний електродний потенціал;
n - число електронів, що беруть участь в процесі;
- концентрація (при точних обчисленнях - активність) гідратованих іонів металу в розчині, моль / дм3;
Визначимо при якій концентрації Zn2 + (в моль / л) потенціал цинкового електрода буде на 0,015В менше його стандартного електродного потенціалу для чого використовуємо рівняння Нернста:
0,059 * lg [Zn2 +] / n = Е (Zn2 + / Zn) - Е0 (Zn2 + / Zn)
lg [Zn2 +] = 0,015 * 2 / 0,059 = 0,5
Завдання № 000
При електролізі розчину CuSO4 на аноді виділилося 168 см3 (н. У.) Газу. Складіть електронні рівняння процесів, що відбуваються на електродах, і обчисліть, яка маса міді виділилася на катоді.