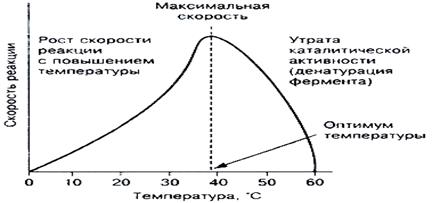
Пріповишеніі температури активність ферменту підвищується. Подальше підвищення температури погіршує каталітичні можливості ферменту, настає теплова денатурація ферменту. Тому залежність v (T) має колоколообразний вид, з різким падінням активності в області високих температур. Термічна стійкість для різних ферментів - різна. До термічно нестійким відносяться. наприклад, кінази, що втрачають активність при 43 о С. Є ферменти стійкі до 100 о С. Така стійкість характерна для бактеріальної ДНК полімерази, що використовується для ДНК діагностики (полімеразної ланцюгової реакції, ПЛР).
Залежність швидкості ферментативної реакції від рН:
рН характеризує кислотність середовища. Чим менше рН, тим більш кисле середовище.
При протонировании білка змінюється його просторова структура і ферментативна активність. Більшість ферментів мають оптимум активності при рН близькому до 7 (нейтральному середовищі). Однак, як видно на малюнку оптимум пепсину лежить в кислому середовищі
2), а оптимум лужноїфосфатази в лужному середовищі (рН
При додаванні кислоти до ферменту відбувається протонирование ряду амінокислот. Це може привести до зміни просторової структури ферменту, або до змін в активному центрі. Є ферменти які дуже чутливі до зміни рН, а є такі, які працюють в широкому діапазоні рН. Уявімо собі активний центр. Його завдання, підлаштовуючись під перехідний стан ферменту максимально знизити енергію перехідного стану субстратів (енергію активації). Для цього навколо тих зв'язків, які повинні розірватися розміщуються електроакцепторние групи амінокислот, а там де повинні утворитися зв'язку - електродонорние групи. У ферментах Протеїди в ферментативном каталіз беруть участь коферменти. Для ферментативного каталізу характерні следующии підходи:
1.Ферменти специфічно пов'язують субстрати в активному центрі. При цьому субстрати орієнтуються таким чином, що набувають оптимальне положення для освіти перехідного стану.
2. Крім того, відбувається видалення гідратної оболонки субстрату. В результаті створюються абсолютно інші умови, ніж в розчині.
3. Внаслідок взаємодії між амінокислотними залишками білка і субстратом відбувається стабілізація перехідного комплексу ЕS.
4. Часто здійснюється перенесення протонів. Це ферментативний кислотно-основний каталіз.
5. Часто хімічні угруповання ковалентно приєднуються до залишків ферменту. Це явище називають ковалентним катализом.
6. Взаємодія з радикалами амінокислот викликають деформацію субстрату, (деформаційний каталіз), що полегшує перебіг процесу.