Для рідин, розчинних один в одному в будь-яких співвідношеннях, виконується закон Рауля. Якщо позначити тиск насиченої пари розчинника над чистим розчинником через р 0. а над розчином - через р, то ставлення (Р 0 - Р) / Р 0 буде називатися відносним зниженням тиску пара над розчином. Різниця (р 0 - р) =? Р називається абсолютним зниженням тиску пара. Математичним виразом закону Рауля є рівняння (Р 0 - Р) / Р 0 = Х, де Х - молярна частка розчиненої речовини.
Отже, закон Рауля показує, що відносне зниження тиску насиченої пари розчинника над розчином дорівнює мольної частці розчиненої речовини.
Якщо мова йде про розчинах твердих нелетких речовин в летючих розчинниках, то парціальними тисками розчинених речовин нехтують. Закон Рауля справедливий для розчинів неелектролітів з дуже низькою або високою концентрацією одного з компонентів. У проміжних концентраціях властивості розчинів відхиляються від ідеальних, що говорить про наявність взаємодії між розчинником і розчиненим речовиною.
Зниження тиску насиченої пари над розчином впливає на температури кипіння і замерзання розчинів. Оскільки між молярної частки розчиненої речовини і тиском пари над розчином існує пряма залежність, то зрозуміло, що вплив розчиненого речовини на температури кипіння і замерзання розчинів також пов'язано з його концентрацією.
Досліджуючи замерзання і кипіння розчинів, Рауль встановив наступні закономірності:
1) підвищення температури кипіння розчину пропорційно кількості молей розчиненої речовини за умови, що кількість молей розчинника постійно:
де Е - ебуліоскопічна константа, величина якої має цілком певне значення для кожного розчинника і не залежить від природи розчиненої речовини; Сl - моляльна концентрація речовини. Фізичний сенс ебуліоськопічеський константи полягає в тому, що при Сl = 1 вона дорівнює підвищенню температури кипіння одномоляльного розчину, так як в цьому випадку δtкіп = Е
2) зниження температури замерзання розчину пропорційно числу молей розчиненої речовини при постійній кількості розчинника:
де К - кріоскопічна константа, величина якої не залежить від природи розчиненої речовини, а залежить тільки від природи розчинника.
Отже, деякі фізичні властивості розбавлених розчинів (тиск парів над розчином, температури кипіння і замерзання) залежать від концентрації і не залежать від природи розчинених речовин в розчині. Тому ці властивості називаються Колігативні (від лат. Colligatus_собірать).
При вивченні властивостей розчинів широко застосовують напівпроникні перегородки -мембрани, характерною особливістю яких є їх здатність пропускати молекули розчинника, але затримувати частинки розчиненої речовини. (Рис. 3).
Явище масопереносу розчинника через напівпроникну мембрану, крізь яку можуть проникати малі молекули, але не здатні проходити великі молекули з розведеного розчину в розчин більш високої концентрації, називається осмосом.
Тиск, який необхідно створити з того боку мембрани, де знаходиться розчин, щоб призупинити осмос, називається осмотичним тиском. Вивчення явища осмосу дозволило Вант-Гофф вивести рівняння, в якому показана залежність осмотичного тиску (розчинів неелектролітів) від концентрації: осмотичний тиск дорівнює тому тиску, яке виробляло б розчинена речовина, якби воно у вигляді ідеального газу займало той же обсяг при тій же температурі :
де π - осмотичний тиск розчину, Па; С - концентрація в моль / л; R-універсальна газова постійна; Т - абсолютна температура.
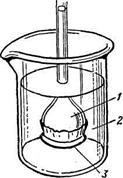

Рис.3. Прилад для демонстрації осмосу: 1 - розчин; 2 - розчинник; 3 - напівпроникна мембрана
Молярна концентрація розчину визначається за формулою
де m - маса розчиненої речовини; M - молярна маса речовини; V - об'єм розчину. Підставляючи цей вираз в рівняння Вант-Гоффа, отримаємо
Описані Колігативні властивості (підвищення температури кипіння розчинів, зниження температури замерзання, осмотичний тиск) відносяться до нескінченно розведених розчинів неелектролітів.
Введення в розчин електролітів (солей, кислот і підстав) також впливає на колігативні властивості, однак в цьому випадку є деякі особливості, пов'язані з природою самих електролітів. Так, якщо в воді розчинити 1 моль NaCl, то в результаті розпаду молекули на іони в розчині з'являються 2 моль іонів (1 моль Na + і 1 моль С1), а кожен з цих іонів надає свою незалежну дію на розчин. Слід очікувати, що у водних розчинах NaCl (і подібних до нього молекул) Колігативні властивості будуть проявлятися вдвічі сильніше, ніж, наприклад, у розчину цукру у воді. Це припущення підтверджено експериментально. Так, зниження температури замерзання розчину, що містить 1 г NaCl в 100 г води, майже вдвічі більше δtзам. розрахованої за законом Рауля.
Аномальне вплив іонних з'єднань на колігативні властивості стає все більш вираженим при великих іонних зарядах. Щоб останнє рівняння було застосовано для визначення осмотичного тиску розчинів, Вант-Гофф ввів в нього поправочний коефіцієнт i (ізотонічний коефіцієнт), який, по суті, вказує ефективне число іонних або молекулярних частинок, що утворюються з одного благаючи розчиненої речовини. Тому рівняння набирає вигляду P = 1000i (m / MV) RT
Багато біологічні процеси, що протікають в рослинному і тваринному організмі, пов'язані з осмосом завдяки наявності в них так званих біологічних мембран. Оболонки клітин є мембрани, які проникні для води, по не пропускають речовини, розчинені у внутрішньоклітинної рідини. Внутрішнє середовище клітини відрізняється від зовнішньої по в'язкості, хімічного складу, вмісту іонів і т. Д. Зовнішня мембрана обмежує внутрішнє середовище від зовнішньої і підтримує ці відмінності протягом усього життя клітини. Зміна хімічного складу навколишнього середовища клітини призводить до зміни осмотичного тиску, з чим пов'язані такі важливі біологічні процеси, як тургор. плазмоліз і гемоліз.
Не володіючи здатністю насмоктувати або відкачувати воду безпосередньо, клітини регулюють приплив і відтік води, змінюючи концентрацію знаходяться в них розчинених речовин. Щоб поглинути більше води, клітина поглинає більше іонів різних солей, молекул глюкози або інших розчинних з'єднань. В результаті в клітині підвищується концентрація розчинених частинок. Вода за законами осмосу починає надходити в клітину, прагнучи до вирівнювання своєї власної концентрації по обидва боки мембрани.

Так працює ця система до тих пір, поки концентрація розчинених речовин поза клітиною і в клітці приблизно однакова. Якщо в середовищі концентрація розчинених речовин вище, ніж в самій клітині, або якщо середовищем для клітини служить практично сухе повітря, то клітина втрачає воду і зморщується, як це буває, коли рослини прівядают в сухий жаркий день. З відпливом води вміст клітини стискається і відходить від клітинних стінок (рис. 1).
Мал. 1. Тургор і завядание у рослин.
А. Рослинні клітини, оточені розведеним розчином, поглинають воду шляхом осмосу через клітинну мембрану і залишаються тургесцентнимі. Б. Рослинні клітини, оточені концентрованим розчином, втрачають воду внаслідок осмосу, і рослина завядает.
Якщо, проте, зів'яле рослина помістити в воду, то вода знову надходить у клітини. Вони стають тургесцентнимі, тобто набухають від води і знову притискаються до клітинних стінок, підкоряючись тургорного тиску, спрямованому зсередини назовні. Клітинні стінки здатні розтягуватися лише до певної межі, після якого вони починають надавати засунений, витісняють воду з клітин з такою ж швидкістю, з якою вона в них надходить. Таким способом клітинні стінки захищають клітини: не дають їм лопнути під напором надлишку води.
Багато тварин клітини, якщо помістити їх в чисту воду або в дуже розбавлений розчин, лопаються, тому що у них немає клітинних стінок (рис. 2).
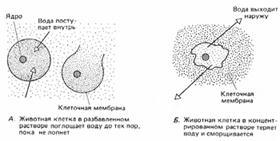
Мал. 2. Осмос в тваринній клітині.