В даний час терапевтичні можливості лікування ІХС включають вплив на клінічну симптоматику захворювання і зниження ризику розвитку інфаркту міокарда, серцевої смерті шляхом зниження дисбалансу між потребою міокарда в кисні і доставкою його, профілактики прогресування захворювання, відновлення коронарного кровотоку шляхом ангіопластики коронарних артерій або реваскуляризацією міокарда. Незважаючи на досягнуті успіхи в лікуванні ІХС, рівень смертності від цього захворювання залишається високим, що вимагає розробки нових підходів в терапії ІХС. Генна терапія, зокрема, із застосуванням ангіогенних факторів росту є потенційно новим методом лікування серцево-судинних захворювань. За останні роки були проведені численні експериментальні дослідження по вивченню факторів ангіогенезу і перші клінічні дослідження у хворих на ішемічну хворобу серця і периферійними захворюваннями судин [3; 5]. Ангіогенез являє собою складний багатоступінчастий процес утворення нових судин шляхом отпочковиванія або за допомогою тріщин (splitting) з уже існуючих [2; 4]. Ангіогенез складається з декількох послідовних етапів: 1) вазодилатації, 2) міграції з адгезією і проліферацією ендотеліальних клітин і 3) власне формування судинної стінки нової тришарової судинної трубки, яка розвивається в міру відновлення циркуляції [4]. Для утворення судин більших, ніж капіляри, необхідна міграція гладком'язових клітин, а також їх адгезія до новоутвореного матриксу нових судин. В експерименті модифікацією цих стадій можна стимулювати і пригнічувати ангіогенез. Серед ряду факторів, що беруть участь в регуляції ангіогенезу, найбільш важливим є судинний ендотеліальний фактор росту СЕФ (Vascular endothelial growth factor - VEGF) і його гомологи [4]. VEGF, будучи основним індуктором ангіогенезу, являє собою глікопротеїн, що збільшує судинну проникність, селективно надає мітогенний ефект на ендотеліоцити, він продукується самими ендотеліальними клітинами в умовах гіпоксії [1; 3]. Рівень експресії VEGF прогресивно зменшується після народження і мінімальний в більшості тканин дорослих, за винятком місць активного ангіогенезу - таких, як яєчники, матка, шкіра (ріст волосся). Високий рівень VEGF в легких у дорослих може бути пов'язаний з ендотеліальними фенестраціі [3]. Однак експресія VEGF може реактивировать при певних умовах - таких, як наявність ішемії міокарда, сітківки, запального процесу, пухлини [1; 9; 10; 12].
Капілярна мережа міокарда відіграє важливу роль в транспорті кисню і поживних речовин до кардіоміоцитів. Підвищена капілярна щільність в міокарді забезпечує більш високу активність міокардаільного кровотоку, перфузії і метаболізму міокарда в умовах ішемії. Зміна щільності і обмінної поверхні капілярної системи мікроциркулярного русла може бути індуковано процесом ангіогенезу.
Метою цього дослідження було вивчення впливу VEGF-164 на ріст і розвиток, а також стан гемомікроциркуляції пошкодженого міокарда, викликаного окклюзией передньої низхідної гілки коронарної артерії в периинфарктной і віддаленій від інфарктного вогнища зонах міокарда в експерименті.
Експерименти поставлені на 22-х білих безпородних щурах самцях масою 200-250 гр. Першу групу тварин склали 6 інтактних щурів, другу групу (n = 8) - контрольні піддослідні тварини, яким проводили окклюзию передненісходящей коронарної артерії. Третій групі піддослідних тварин (n = 8) попередньо внутрішньовенно вводили препарат VEGF-164 в дозі 0,3 мкг / кг і виробляли окклюзию коронарної артерії.
Препарат VEGF, що вдає із себе поліпептид, що складається з 164 амінокислот, вводили в дозі 0,3 мг / кг після розчинення в 1 мл буферного розчину і центрифугування протягом 5 хв. Препарат вводили інтраміокардіально.
Експериментальний некроз міокарда відтворювався шляхом оклюзії лівої передньої низхідної коронарної артерії (ЛКА) при лівій стернотомии під нембуталовим наркозом (внутрішньочеревно, 40 мг / кг) в умовах штучної вентиляції легенів. Перед проведенням анестезії тварин проведена ін'єкція атропіном 0,04 м 2 / кг з метою запобігання набряку слизової при інтубації трахеї. Декапітацію виробляли на 7-й день після оклюзії в умовах нембуталовой анестезії.
Для вивчення морфологічного стану міокарда використовувався загальноприйнятий метод забарвлення гематоксилін-еозином.
Гемомикроциркуляторного русло вивчалося на мікроскопічних препаратах міокарда, оброблених модифікованим методом Гоморі по С.А.Сісакяну [7]. За допомогою окуляр-мікрометра вимірювався середній діаметр капілярів (d), розраховувалися щільність (загальна довжина - L), обмінна поверхня капілярів (ОПК) і ємність капілярного русла (ЄКР) на 1 мм 3 миокардиальной тканини.
Статистична обробка даних проводилася за t-критерієм Стьюдента.
Отримані нами дані показали, що на 7-й день після оклюзії в осередку некрозу виявлялися значна кількість некротичних елементів і поодинокі фрагменти капілярів, тоді як після введення VEGF судинна реакція була більш виражена.
При дослідженні мікроциркуляторного русла міокарда у інтактних тварин були виявлені паралельно розташовані і рівномірно наповнені капіляри, а також поперечна смугастість кардіоміоцитів (рис. 1).

Мал. 1. Міокард інтактних тварин. Паралельно розташовані капіляри і поперечнасмугастість м'язових волокон. 7 x 40.
У контрольних тварин було характерно наявність численних світлих полів, позбавлених судинних елементів. У сусідніх з некрозом ділянках міокарда виявлялися густо розташовані і нерівномірно заповнені капіляри. Одночасно з цим стінки капілярів офарблювалися більш інтенсивно, багато хто з них покручені, з нерівномірними контурами. У багатьох полях зору повністю була відсутня поперечна смугастість м'язових волокон (рис. 2). У міокарді тварин, які отримали VEGF виявлялося більш щільне розташування капілярів, анастомірующіх один з одним і утворюють своєрідну капілярну мережу в ділянках, що безпосередньо прилягають до некрозу (рис. 3). У більш віддалених від некрозу ділянках капіляри розташовувалися паралельно одна до одної, маючи правильний хід з рівними контурами.
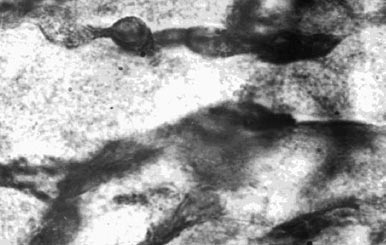
Мал. 2. Оклюзія лівої коронарної артерії. Паранекротіческая зона. Контури капілярів нерівні, забарвлення стінок нерівномірна, капіляри утворюють мікроаневрізматіческіе розширення. 10 x 40
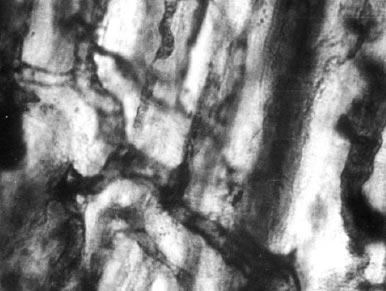
Мал. 3. Сформована капілярна мережа в ділянках міокарда, прилеглого до некрозу на 7-й день після оклюзії коронарної артерії. 10 x 40.
При морфометричної оцінці капілярної системи перінекротіческой зони середній діаметр капілярів майже не відрізнявся від такого у контрольних тварин в межах достовірності (3,3%, р> 0,1) Відзначається збільшення щільності функціонуючих капілярів (14,7%, р<0,05) и ОПК (12,1 %, р<0,05) в этих участках (табл.1). В более отдаленных отделах миокарда капилляры располагались параллельно друг к другу, их средний диаметр и количество функционирующих капилляров в пределах достоверности не отличались от таковых в перинекротической зоне.
Таблиця 1
Морфометрические зміни мікроциркуляторного русла міокарда в перінекротіческой зоні при оклюзії ЛКА і застосуванні VEG
Параметри МЦР міокарда
Примітка: * p <0,05, достоверность разницы с интактными животными; #p <0,01 – достоверность разницы между животными с окклюзией ЛКА и животными, дополнительно получившими VEGF.
У групі тварин, які отримали попередню ін'єкцію VEGF-164, зазначалося більш щільне розташування капілярів як в перінекротіческой зоні (збільшення на 24,8%, р<0,01), так и в отдаленных от него участках. Морфометрические измерения показали отсутствие изменения среднего диаметра капилляров от таковых у контрольных крыс (2,8 %, р>0,1), однак при цьому кількість функціонуючих капілярів досягало достовірно великих значень як в перінекротіческой зоні (24,8%, р<0,01), так и отдаленных от него участках. Именно благодаря увеличению количества функционирующих капилляров наблюдалось значительное увеличение ОПК (25,1 %, р<0,01).
Одним з перспективних напрямків в експериментальній кардіології є лікування ішемії міокарда шляхом неоваскуляризации серця за допомогою так званих "ангіогенного", медіаторів індукують утворення судин. Міокардіальне ангіогенез має місце в організмі і може бути стимульований при гострій ішемії, ішемічному Прекондиціонування [1; 6]. При цьому процес індукції ангіогенезу супроводжується активацією ряду факторів транскрипції - Staf 3; SP-1 Pax-5 [4]. Ряд досліджень показав, що кюбель судинна система захищає ішемізованих міокард при гострій коронарній оклюзії.
В даний час є багато невирішених питань щодо методів введення VEGF з метою терапевтичного ангіогенезу. Результати проведених досліджень при застосуванні факторів ангіогенезу суперечливі. У дослідженні FIRST відзначалося підвищення толерантності до фізичного навантаження при інтракоронарне введенні білка основного фактора росту фібробластів (b-FGF) у хворих старше 65 років з вираженою стенокардією. У рандомізованому дослідженні REVASC при порівнянні 2-х груп хворих з важкою стенокардією введення гена VEGF-121 в складі аденовірусу в стінку ЛШ після мініторанотоміі спостерігалося поліпшення даних тредміл-тесту (збільшення часу до появи болів) і до виникнення депресії сегмента ST більше 1 мм) було відзначено через 26 тижнів [8]. Внутрішньовенне введення або введення в "дистальний артеріальний кровотік" ангіогенних факторів росту може послужити причиною системних реакцій, наприклад, зростання судин в невиявлених пухлинах, гіпотензії [2; 3]. У зв'язку з цим становить інтерес вплив інтраміокардіальной ін'єкції VEGF щоб уникнути ряду системних небажаних побічних ефектів. З огляду на вищевикладене, ми в наших експериментах апробували саме цей метод введення VEGF.
Капілярна мережа грає ключову роль в транспорті кисню енергетичних субстратів і кардіоміоцитах. Підвищена капілярна щільність в міокарді, що спостерігається при ішемії, вказує на фізіологічну значимість гіпоксііндуцірованного збільшення рівня ендотеліальних митогенов і їх рецепторів [2, 10]. Зокрема, вже через 24 год. Після накладення лігатури на ліву коронарну артерію в експериментальних умовах на моделях тварин спостерігалося достовірне збільшення рівня VEGF [12]. Відомо, що активація ендогенної експресії VEGF є раннім відповіддю на міокардіальну ішемію. Ця відповідь, здійснюваний на молекулярному рівні, є одним з перших адаптаційних механізмів міокарда на ішемію [1; 3; 13].
На моделі експериментального некрозу і терапії фактором ангіогенезу VEGF нами встановлено, що терапія названим чинником активує процес ангіогенезу як в перінекротіческой зоні, так і у віддалених від некрозу зонах шляхом підвищення кількості функціонуючих капілярів і обмінної поверхні капілярного русла. Виразність судинної реакції на 7-й день експерименту, щільне розташування капілярів і наявність безлічі анастомозів вказує на активацію колатеральногокровообігу в перінекротіческой зоні у щурів контрольної групи. Зазначені зміни є адаптивно-пристосувальних механізмом при гострій ішемії міокарда та описані в численних експериментальних дослідженнях з моделювання інфаркту міокарда і у хворих ГІМ. Одним з можливих механізмів даних змін є активація ендогенного ангіогенезу в серці за участю ряду факторів росту. Попереднє введення VEGF, на відміну від контрольних тварин, призводило до збільшення щільності судинної системи не тільки в перінекротіческой зоні, а й у віддалених від неї ділянках.