ВИЗНАЧЕННЯ приріст ентропії при плавленні КРИСТАЛ-вої ВЕЩЕСТВА
Мета роботи. розібратися в формулюванні 2-го початку термодіна-міки, дати поняття ентропії і визначити питомий приріст ентропії. Приладдя. тигель з оловом, нагрівач (електроплитка),
термопара, мілівольтметр, градіровочная крива (для визначення температур).
Коротка теорія і опис установки. Перший початок термодінамі-ки свідчить: кількість тепла, повідомлене системі, йде на прир-щення його внутрішньої енергії і на здійснення роботи даної сис-темою.
Але перший початок не визначає напрямки процесу. Так не про-суперечить першому закону термодинаміки мимовільний пере-хід внутрішньої енергії від менш нагрітого тіла до більш нагре-тому. На практиці такий перехід не спостерігається. Необхідно най-ти критерій спрямованості процесу.
Процес називається оборотним, якщо система може повернутися в первісний стан, причому після оборотного процесу не відбувається ніяких змін у навколишньому середовищі.
Реальні процеси пов'язані з необоротними втратами, поет-му теплова машина тим вигідніше, чим ближче до оборотного процес-су її робочий цикл. Знайдемо міру незворотності процесу в ізольо-рова системі (системі з теплоізоляційними стінками).
Розглянемо ідеальний газ, що знаходиться в певному сос-тояніе і характеризується параметрами Р. V. Т. Так як мо-лекул газу в даний момент можуть мати якісь координати і швидкості, то кожне макроскопическое стан системи буде являти собою безперервну зміну близьких микросостояний, ко-торие відрізняються один від одного розподілом одних і тих же мо-лекул в різних частинах V.
Число микросостояний, якими здійснюється дане макросостояніе, називається статистичною вагою, або термодінамічес-кою ймовірністю цього макросостоянія (W) і характеризує ступінь безладності макросостоянія всієї системи.
Чим більше термодинамічна ймовірність, тим більше сте-пень безладності стану системи.
Больцман ввів в якості опції, що визначає міру беспо-рядочності теплового руху, величину, пропорційну логарифму термодинамічної ймовірності.
де k- постійна Больцмана.
Функція називається ентропією системи. Так як термодінамічес-кая ймовірність є функцією параметрів стану, то ент-ропія теж є функцією цих параметрів.
При плавленні твердого тіла порушується упорядкованість мо-лекул і атомів, тому ентропія системи повинна змінитися.
З теорії ймовірностей відомо, що якщо система складається з декількох незалежних частин з термодинамічними вероятнос-тями W1, W2, ... Wn, то термодинамічна ймовірність всієї системи:
і ентропія згідно з визначенням (формула 2).
Якщо рух системи абсолютно впорядкування, то таке відбутися у-яние системи здійснюється єдиним способом і його термо-динамічна ймовірність W = 1. отже, S = 0. Отже, чим
більше S. там більше ступінь молекулярного безладу. Статистичні та термодинамічні розрахунки показали, що пріращена-ня ентропії системи чисельно дорівнює кількості теплоти, пові-щенному тілу в ході оборотного процесу, поділеній на абсолют-ву температуру тіла, при якій відбувається передача теплоти:
- називається наведеним кількістю теплоти.
Таким чином, оборотними процесами є ті процеси, при яких ступінь безладності молекулярних рухів у всій системі тіл, що беруть участь в процесі, не збільшується і Ентре-Пія залишається постійною. При необоротних процесах ступінь хаотичності молекулярних рухів збільшується і ент-ропія всієї системи зростає.
Отже, у всіх процесах, що відбуваються в природі,
Це і є математична запис другого закону термодинаміки, яке стверджує, що мимовільний перехід тепла від менш нагрітого тіла до більш нагрітого неможливий. Сказане вище означає, що ступінь незворотності визначається зростанням ентропії.
Зміна ентропії при плавленні кристалічного тіла можна розглядати за формулою (3) в диференціальному вигляді;
Використовуючи (4) перший початок термодинаміки (1) можна записати:
При зміні температури від 0 до рівняння (5) набуде вигляду:
де - вільна енергія, яка при даній температурі може бути використана для здійснення зовнішньої роботи, TS - зв'язана енергія, це та частина внутрішньої енергії, яка при даній температурі не може бути звернена в роботу.
Зі співвідношення (6) можна зробити висновки:
1. Внутрішня енергія системи U дорівнює, сумі його вільної та зв'язаної енергій.
2. При даній температурі Т зовнішня робота може бути здійснена тільки за рахунок вільної енергії системи.
3. Вільна енергія визначає фізичний зміст ентропії, чим більше ентропія, тим менше вільна частина енергії системи, т. Е. Ентропія - це міра тієї частини енергії, яка не може бути використана для здійснення спрямованих процесів.
Знайдемо формулу для обчислення приросту ентропії при плавленні кристалічного тіла. Згідно з визначенням, приріст ентропії
Індекси 2 і 1 означають початок і кінець процесу нагрівання тіла від початкової температури Т1 до закінчення процесу плавлення, який відбувається при температурі Т2:
де С і m теплоємність і маса твердої речовини при, так само
де А - питома теплота плавлення речовини. Підставивши (8) і (9) в (7), отримаємо:
У даній роботі будемо визначати питомий приріст ентропії, яке не залежить від маси плавиться речовини.
1. Виміряйте температуру повітря в лабораторії - Т /.
2. Увімкніть електроплитку, спостерігайте за показаннями мил-лівольтметра і при досягненні температури 20-30 ° С пустите сєку;
домер. Записуйте показання мілівольтметра кожну хвилину.
3. Вимкніть плитку відразу після розплаву олова.
4. Знайдіть температуру олова в тиглі за формулою 7 = li ^ ul
де // - кімнатна температура за шкалою Кельвіна, 4 / - показу-ня мілівольтметра.
ПРИМІТКА. Шкала мілівольтметра про градуирована в градусах Цельсія. Так як термопара завжди реагує на різницю темпера тур, то показання мілівольтметра представляють собою різницю між температурою олова в тиглі і кімнатної.
5. Побудуйте графік зміни температури олова в тиглі, відклавши по осі абсцис час, а по осі ординат температуру /.
6. Знайдіть за графіком температуру плавлення олова 7z •
7. За формулою (II) знайдіть зміна ентропії.
1. Як читається перший початок термодинаміки?
2. Сформулюйте другий закон термодинаміки.
3. Який фізичний зміст ентропії ^
4. Що означає поняття "пов'язана енергія"?
5. У чому полягає статистичне обгрунтування другого початку термодинаміки?
6. Що таке теплота плавлення?
7. Що таке вільна енергія і як вона пов'язана з ентропією?
8. Чи необхідно в даній роботі знати масу олова, і чому?
1. Савельєв загальної фізики. Т. I.-М.: Наука, 1982, с ..
2. Трофимова фізики.-М.: Вища школа, 1985, с.59-92.
ВИЗНАЧЕННЯ КОЕФІЦІЄНТА ДИФУЗІЇ І СЕРЕДНЬОЇ ДОВЖИНИ ВІЛЬНОГО ПРОБІГУ МОЛЕКУЛ ВОДЯНОГО ПАРА В ПОВІТРІ
Мета роботи: вивчити явище дифузії і практично визначити
коефіцієнт дифузії. Приналежності: повітряний дзвін, відліковий мікроскоп, термо-
• метр, крапельниця, кювета з водою, кювета з поглинутої-Через кожну сферичну поверхню, концентричну поверхню краплі, має проходити однакову кількість вещест-ва (речовина ніде не витрачається і не з'являється ззовні).
З рівняння I, враховуючи, що л -5 = ^ Х г, отримуємо:
Інтегруючи (2) і приймаючи, що при 1 ^ 1 -i (радіус краплі) J ^ дорівнює щільності насиченої водяної Параті при даній температурі, висловимо щільність водяної пари на будь-якому расстоя-ванні від центру краплі:
Графічно залежність Р від Т- представлена на рис. I. Вели-
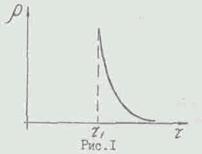
чину Р залежить від вологопоглинаючого-щей здатності осушувача. У даній роботі вона практично дорівнює нулю на відстанях трохи великих 7 /, так як в якості осушувача викорис-зуется сильний поглинач вологи - селикагель.
З огляду на, що при 7- • ex », р-'D, з рівняння 3 знаходимо формулу для
розрахунку коефіцієнта дифузії водяної пари, в повітрі:
Маса водяної пари, дифундувати через любуто Сфера-чесіута поверхню за час Лt. дорівнює зміні маси краплі за. то we час. Припустимо, що в момент часу Г радіус кап-ли - 7у, а в момент часу 2 "/ - Z ^. Тоді
Так як 7 ^ мало відрізняється від 1 /, то, використовуючи формули наближених обчислень для знаходження (7 /
^^) »(5) можна записати у вигляді;
Підставивши (6) в (4), знаходимо
про молекулярно кінетичної теорії доводиться, що
де \ Л / - середня довжина вільного пробігу молекул;
- середня арифметична швидкість теплового дві-вання молекул.
де К. - універсальна газова постійна
/ - абсолютна температура навколишнього середовища, U. - молярна маса водячи пара.
Вимірювання радіуса краплі проводиться таким чином: домагаються такого положення мікроскопа, при якому шкала оку-лярного мікрометра збігається з горизонтальним діаметром краплі і чітко видно краю краплі (рис.3). Зятя »* знімають відліками v відповідають положенням правого і лівого країв краплі. Радіу! краплі дорівнює:
Порядок виконання роботи
1. Визначте температуру навколишнього середовища.
2. За допомогою крапельниці повісьте на кінчик стійки невеликі-шую краплю.
3. Перевірте наявність поглинача вологи.
4. Накрийте ковпаком краплю і поглинач ..
5. Наведіть мікроскоп на краплю.
6. Зробіть перший відлік діаметра краплі (CLі г) і сраз пустите в хід секундомір. Результат відліку занесіть в таблицю. Через 10-15 хвилин знову розташуйте вісь шкали мікроскопа по діа метру краплі, сфокусуйте зображення, так як в результаті ис-ширяння краплі діаметр її зменшується і фокусування, збивається. Знову виміряйте діаметр краплі і зупиніть секундомір. Залишається-ся краплю зніміть.
7. Розрахуйте коефіцієнт дифузії за формулою 7, визнач по прикладеному до роботи графіком.
8. Досвід повторіть 3 рази.
9. За формулою 9 розрахуйте довжину вільного пробігу молі-кул.
10. Розрахуйте похибки вимірювань.
1. У чому полягає процес дифузії?
2. Від чого за. висить маса диффундирующего речовини.?
3. Від чого залежить коефіцієнт дифузії і який його фізичний смисл9
4. Що таке довжина вільного пробега'7
5. Який фізичний зміст універсальної газової постійної?
6. Що таке градієнт плотності9
7. Виведіть розрахункову формулу.
1. Трофимова фізики. - М. Вища школя, 1985 с. 76.
2. Савельєв загальної фізики. T. I. -М. Наука, 1982, с.
3. Горбунова - практикум по загальній фізіке.-М .;
Просвітництво, 1978, с. 54-55.
Порядок виконання роботи
1. Визначте температуру навколишнього середовища.
2. За допомогою крапельниці повісьте на кінчик стійки невеликі-шую краплю.
3. Перевірте наявність поглинача вологи.
4. Накрийте ковпаком краплю і поглинач ..
5. Наведіть мікроскоп на краплю.
6. Зробіть перший відлік діаметра краплі (CLі г) і сраз пустите в хід секундомір. Результат відліку занесіть в таблицю. Через 10-15 хвилин знову розташуйте вісь шкали мікроскопа по діа метру краплі, сфокусуйте зображення, так як в результаті ис-ширяння краплі діаметр її зменшується і фокусування, збивається. Знову виміряйте діаметр краплі і зупиніть секундомір. Залишається-ся краплю зніміть.
7. Розрахуйте коефіцієнт дифузії за формулою 7, визнач по прикладеному до роботи графіком.
8. Досвід повторіть 3 рази.
9. За формулою 9 розрахуйте довжину вільного пробігу молі-кул.
10. Розрахуйте похибки вимірювань.
1. У чому полягає процес дифузії?
2. Від чого за. висить маса диффундирующего речовини.?
3. Від чого залежить коефіцієнт дифузії і який його фізичний смисл9
4. Що таке довжина вільного пробега'7
5. Який фізичний зміст універсальної газової постійної?
6. Що таке градієнт плотності9
7. Виведіть розрахункову формулу.
1. Трофимова фізики. - М. Вища школя, 1985 с. 76.
2. Савельєв загальної фізики. T. I. -М. Наука, 1982, с.
3. Горбунова - практикум по загальній фізіке.-М .;
Просвітництво, 1978, с. 54-55.