Зміст
електронегативність
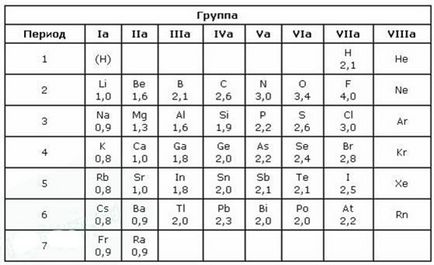
У хімії широко застосовується поняття електронегативності (ЕО) - властивість атомів даного елемента відтягувати на себе електрони від атомів інших елементів в з'єднаннях називають електронегативні. Електронегативність літію умовно приймається за одиницю, ЕО інших елементів обчислюють відповідно. Є шкала значень ЕО елементів.
Числові значення ЕО елементів мають приблизні значення: це безрозмірна величина. Чим вище ЕО елемента, тим яскравіше проявляються його неметалеві властивості. За ЕО елементи можна записати в такий спосіб:
F> O> Cl> Br> S> P> C> H> Si> Al> Mg> Ca> Na> K> Cs

Найбільше значення ЕО має фтор. Зіставляючи значення ЕО елементів від франція (0,86) до фтору (4,1), легко помітити, що ЕО підпорядковується Періодичному закону. У періодичної системи елементів ЕО в періоді зростає зі збільшенням номера елемента (зліва направо), а в головних підгрупах - зменшується (зверху вниз). У періодах у міру збільшення зарядів ядер атомів число електронів на зовнішньому шарі збільшується, радіус атомів зменшується, тому легкість віддачі електронів зменшується, ЕО зростає, отже, посилюються неметалічні властивості.
Різниця електронегативності елементів в з'єднанні (ΔX) дозволить судити про тип хімічного зв'язку.
Якщо величина Δ X = 0 - зв'язок ковалентний неполярний.
При різниці електронегативності до 2,0 зв'язок називають ковалентним полярної. наприклад: зв'язок HF в молекулі фтороводорода HF: Δ X = (3,98 - 2,20) = 1,78
Зв'язки з різницею електроотріцательностей більше 2,0 вважаються іонними. Наприклад: зв'язок NaCl в поєднанні NaCl: Δ X = (3,16 - 0,93) = 2,23.
Електронегативність залежить від відстані між ядром і валентними електронами, і від того, наскільки валентна оболонка близька до завершеної. Чим менше радіус атома і чим більше валентних електронів, тим вище його ЕО.
Фтор є самим електронегативним елементом. По-перше, він має на валентній оболонці 7 електронів (до октету бракує всього 1-го електрона) і, по-друге, ця валентна оболонка розташована близько до ядра.
Електронегативність можна виразити кількісно і вибудувати елементи в ряд по її зростанню. Найбільш часто використовують шкалу електронегативності, запропоновану американським хіміком Л. Полінгом.
Ступінь окислення
Складні речовини, що складаються з двох хімічних елементів, називають бінарними (від лат. Бі - два), або двоелементною (NaCl, HCl). У разі іонного зв'язку в молекулі NaCl атом натрію передає свій зовнішній електрон атома хлору і перетворюється при цьому в іон із зарядом +1, а атом хлору приймає електрон і перетворюється в іон із зарядом -1. Схематично процес перетворення атомів в іони можна зобразити так:
При хімічній взаємодії в молекулі HCl загальна електронна пара зміщується в бік більш електронегативного атома. Наприклад ,, т. Е. Електрон не повністю перейде від атома водню до атома хлору, а частково, обумовлюючи тим самим частковий заряд атомів δ: Н +0.18 Сl -0.18. Якщо ж уявити, що і в молекулі HCl, як і в хлориде NaCl, електрон повністю перейшов від атома водню до атома хлору, то вони отримали б заряди +1 і -1:
Такі умовах а-ні заряди називають ступенем окислення. При визначенні цього поняття умовно припускають, що в ковалентних полярних з'єднаннях зв'язку щие електрони повністю перейшли до більш елек-троотріцательному атому, а тому з'єднання з-стоять тільки з позитивно і негативно заряджених атомів.
Ступінь окислення - це умовний заряд атомів хімічного елемента в з'єднанні, обчислений на основі припущення, що всі з'єднання (і іонні, і ковалентно-полярні) складаються тільки з іонів. Ступінь окислювання може мати негативний, позитивний або нульове значення, яке зазвичай ставиться над символом елемента зверху, наприклад:
Негативне значення ступеня окислення мають ті атоми, які взяли електрони від інших атомів або до яких зміщені загальні електронні пари, т. Е. Атоми більш електронегативний елементів. Позитивне значення ступеня окислення мають ті атоми, які віддають свої електрони інших атомів або від яких відтягнуті загальні електронні пари, т. Е. Атоми менш електронегативний елементів. Нульове значення ступеня окислення мають атоми в молекулах простих речовин і атоми в вільному стані, наприклад:
У з'єднаннях сумарна ступінь окислення завжди дорівнює нулю.

валентність
Валентність атома хімічного елемента визначається в першу чергу числом неспарених електронів, які беруть участь в утворенні хімічного зв'язку.
Валентні можливості атомів визначаються:
• числом неспарених електронів (одноелектронних орбіталей);
• наявністю вільних орбіталей;
• наявністю неподіленого пар електронів.
У органічної хімії поняття «валентність» заміщає поняття «ступінь окислення», з яким звично працювати в неорганічної хімії. Однак це не одне і те ж. Валентність не має знака і не може бути нульовою, тоді як ступінь окислення обов'язково характеризується знаком і може мати значення, рівне нулю.
В основному, під валентністю розуміється здатність атомів до утворення певного числа ковалентних зв'язків. Якщо в атомі є n неспарених електронів і m неподілених електронних пар, то цей атом може утворювати n + m ковалентних зв'язків з іншими атомами, тобто його валентність дорівнюватиме n + m. При оцінці максимальної валентності слід виходити з електронної конфігурації «порушеної» стану. Наприклад, максимальна валентність атома берилію, бору і азоту дорівнює 4.
- H, Na, Li, До, Rb, Cs - Ступінь окислювання I
- О, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd - Ступінь окислювання II
- B, Al, Ga, In - Ступінь окислювання III
Використовуючи валентності можна скласти формулу сполуки.
Хімічна формула - це умовна запис складу речовини за допомогою хімічних знаків та індексів.
Наприклад: Н2 O-формула води, де Н і О-хімічні знаки елементів, 2 - індекс, який показує число атомів даного елемента, що входять до складу молекули води.
При назві речовин зі змінною валентністю обов'язково вказується його валентність, яка ставиться в дужки. Наприклад, Р2 05 - оксид фосфору (V)
I. Ступінь окислювання вільних атомів і атомів в молекулах простих речовин дорівнює нулю- Na0, Р40, О2 0
II. У складному речовині алгебраїчна сума СО всіх атомів з урахуванням їх індексів дорівнює нулю = 0. а в складному йоні його заряду.
Розберемо для прикладу кілька з'єднань і дізнаємося валентність хлору:
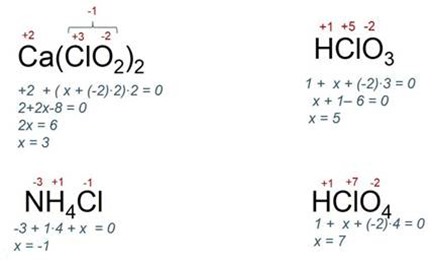

Довідковий матеріал для проходження тестування:

