Тема - 18: Підгрупа Кисню. Аллотропия кисню і сірки. Характеристика елементів підгрупи кисню. Порівняння властивостей водневих з'єднань.
· Особливості будови атом в VI групи.
· Властивості, склад, отримання та застосування найважливіших хімічних сполук.
· Характеризувати загальні властивості неметалів VI групи.
· Складати хімічно формули водневих з'єднань, кислот.
18.1. Загальна характеристика
Головну підгрупу VI групи утворюють елементи киць-лород (О), сірка (S), селен (Se), телур (Те) і полоній (Ро), що мають групову назву «халькогена», що впереводе означає «рудообразователі».
Будова зовнішнього електронного шару атомів цієї під-групи ns2np4. Однакова структура валентного рівня обумовлює схожість халькогенов: всі вони відносяться ксемейству р-елементів, є неметалами (кромеполонія). Маючи на зовнішньому шарі по 6 електронів, атоми цих елементів приєднують відсутні до октету 2 електрона, і в з'єднаннях виявляють нижчу ступінь окислення, рівну (- 2).
Сірка, селен, телур і полоній утворюють також устої-чівие з'єднання, в яких вони проявляють позитивними-ні ступеня окислення.
Електронно-графічна формула атомів халькогенов в основному (не збудженому) стані:
Наявність двох неспарених електронів обумовлюючи-ет типову для всіх халькогеноов валентність, рав-ву II.
У атомів всіх халькогенов (крім кисню) в воз-буждение стані може збільшуватися число неспе-корінних електронів за рахунок переходу електронів сnр - іns-підрівнів на свободнийnd-підрівень. При цьому можливі наступні валентні стану атомів:
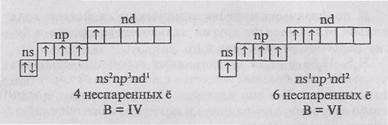
Так як у атома кисню валентними є елек-трони другого рівня, що не мають d-підрівні, то для атомів кисню перехід в збуджений стан не-можливий. Тому кисень має постійну валент-ність П.
Сірка, селен і телур в сполуках з киснем про-являють ступеня окислення +4 і +6. Ці елементи обра-товують оксиди типу ЕО2 і ЕО3, які мають кислотний характер. Відповідні гідроксиди є киць-лотами. До сильних належать тільки сірчана і селеновая кислоти, інші є дуже слабкими. З ростом ступеня окислення зростають і кислотні, і окисні властивості окси-дів і відповідних кислот.
У з'єднаннях з воднем халькогена проявляють ва-лентность, рівну II (ступінь окислення -2).
H2S, H2Se і Н2Те представляють собою при звичайних, умовах газоподібні речовини з неприємним характер-ним запахом. Всі вони отруйні. При розчиненні в воді слабо дисоціюють на іони і тому є слабкі-ми кислотами. Ступінь дисоціації трохи збільшується при переході від H2S до Н2Те. У цьому ж напрямку зменшується міцність молекул (при нагріванні H2Se і Н2Те розкладаються).
Всі сполуки селену і телуру отруйні.
Порівняння властивостей елементів головних підгруп VI. і VII груп, а також їх з'єднань, призводить до наступних висновків:
1. У халькогенов неметалеві властивості висловлю-ни слабкіше, ніж у галогенів.
2. Кисневі сполуки халькогенов (оксиди і кислоти) набагато більш стійкі, чому у галоген-нів.
3.Халькогеноводороди (виключаючи воду) менш полярні і менш міцні, ніж галогеноводороди.
4. У підгрупі халькогенов відмінності між елементом-тами виражені сильніше, ніж у підгрупі галоген-нів.
Найбільш важливими в головній підгрупі VI трупи є кисень і сірка, а також їх з'єднання.
18.2 Кисень і його сполуки
У вільному стані кисень існує у вигляді двох аллотропних модифікацій: О2 - кисень і О3 - озон.
Кисень О2 при звичайних умовах - газ без кольору і запаху; Т = -183 ° С; трохи важчий за повітря, пліт-ність 1,43. У воді малорастворим: в 1 л її при н. у. ра-створяется = 0,07 г. Рідкий кисень - рухлива, злегка блакитнувата рідина.
Озон О3 при звичайних умовах - газ синього кольору, з різким запахом; Ткип = -112 ° С. Розчинність в воді вище, ніж у кисню. Рідкий озон -речовини темно синього, майже чорного кольору. Вибухонебезпечний у всіх агрегатних станах, так як мимовільно розкладає-ся з виділенням великої кількості енергії.
18.2.1 Отримання вільного кисню
Дуже чистий кисень одержують шляхом електроліту-чеського розкладання води в присутності електроліту (на-приклад, Ш " '
У лабораторних умовах кисень можна отримати шляхом розкладання при нагріванні нестійких соеди-нений, що містять в своєму складі кисень, наприклад:

Озон утворюється у верхніх шарах атмосфери (на висо-ті близько 50 км) з вільного кисню. Під впливом ультрафіолетового опромінення молекули кисню дис-соцііруют з утворенням атомарного кисню:
18.2.2. Хімічно властивості кисню
При взаємодії О2 з простими речовинами - ме-Таллі і неметалами - зазвичай утворюються оксиди, наприклад:
Однак є й винятки. Наприклад, при окис-лення киснем таких лужних металів, як натрій і калій, утворюються головним чином пероксиди (а ок-сіди являютсяпобочним продуктом):
Майже всі реакції за участю О2 екзотермічни, за рідкісним винятком:
Характерною особливістю багатьох реакцій з'єднань-ня з киснем є виділення теплоти і світла. Такі реакції називаються горінням.
Багато складні речовини також окислюються кисло-родом. При взаємодії О2 з водневими з'єднань-нями неметалів утворюється вода, і неметалл виділити-ється або у вільному стані, або у вигляді свого ок-сіда, в залежності від умов проведення реакції:
Під дією кисню нижчі оксиди і гідроксиди переходять до відповідних з'єднання з більш ви-сокой ступенем окислення:
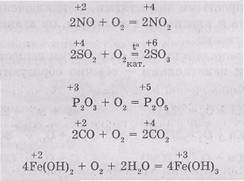
У кисні згоряють практично всі органічні
речовини. Продуктами повного окислення є, глав-ним чином, вуглекислий газ і вода.
18.2.3. Перекис водню
Являє собою безбарвну рідину з Тпл = -0,41ºС і Ткип = 150, 2ºС і щільністю 1,45 г / см3. У чистому вигляді пероксид водню вибухонебезпечний.
Розчин пероксиду водню має кислу реакцію, що обумовлено дисоціацією його молекул за типом слабкої кислоти:
Деякі пероксиди металів, наприклад Na2O2, ВАО2, можна розглядати як солі слабкої кислоти пероксі-да водню. З них можна отримувати Н2О2 дією бо-леї сильних кислот:
Пероксиди характеризуються наявністю в молекулах перекисной ланцюжка з атомів кисню:
18.3.1. Сірка та її сполуки
Відносна електронегативність сірки набагато нижче, ніж у кисню, тому в порівнянні з ним окис-лительного здатність сірки в значній мірі ослаб-лена.
Проте, сірка утворює стійкі сполуки з воднем і металами, в яких знаходиться в ступені окислення -2, Але, на відміну від кисню, сірка суще-ствует в з'єднаннях і в позитивній ступеня окислення. До найважливіших сполук, що утворюються сірої в різних ступенях окислення, відносяться наступні:
18.3.2Аллотропія вільної сірки
У вигляді простого речовини сірка має велике число аллотропних модифікацій, що розрізняються між со-бій складом і будовою молекул. Число атомів в молі-Кулах різних алотропія сірки змінюється в широ-кому діапазоні - від 3 до 20; молекули можуть мати цик-вої і лінійну будову.
У звичайних умовах сірка існує у вигляді ромба-чеський модифікації. Її молекули містять по 8 атомів сірки, з'єднаних одинарними ковалентними зв'язками в замкнутий цикл.
Ромбическая сірка - тверда кристалічна віщо-ство жовтого кольору, практично нерозчинний у воді, але добре розчинний в сероуглероде CS2 і ацетоні.
При температурі вище 95 ° С ромбическая сірка пре-обертається в моноклинную модифікацію: Розплави сірки містять майже всі її аллотропии.
У лабораторних умовах вільну сірку можна по-лучити з її з'єднань з допомогою окисно-вос-становітельних реакцій, наприклад:
18.3.3. Хімічні властивості сірки
Сірка - хімічно активний неметалл. Відомі її сполуки майже з усіма елементами, крім інертних газів, золота і платинових металів.
При взаємодії з простими речовинами, образо-ванними елементами з меншою ЕО, сірка виявляє окис-лительного властивості: S0 + 2ё → S2-
При взаємодії з простими речовинами, образо-ванними елементами з більшою ЕО, сірка виявляє вос-становітельние властивості:
Так, сірка горить на повітрі блакитним полум'ям, при цьому утворюється діоксид сірки:
Фтор запалює сірку вже при звичайній температу-ри з утворенням гексафториду сірки:
S + 3F2 → SF6
Хлор і бром реагують з сіркою при невеликому нагріванні з утворенням галогенідів, наприклад:
S + Cl2 → SCl2
У водних розчинах лугів при нагріванні сірка під-Вергал самоокісленія - самовідновлення (диспропорціонування):
Сірководень H2S - безбарвний, сильно отруйний газ з неприємним запахом; Тпл. = - 85 ° С і Ткип = -60 ° С. Ра-створімость H2S у воді невелика (при кімнатній темпе-ратурі в одному об'ємі води розчиняється 2,5 об'єму H2S).
У природі сірководень утворюється у великих кількістю-ствах за рахунок біохімічних процесів.
Бактерії, що виробляють H2S є найбільш древ-ними організмами на Землі. Сірководень міститься також в вулканічних газах і в водах мінеральних джерел.
У промисловості і в лабораторії сірководень напів-ють дією сильних кислот на сульфіди металів.
Будучи двухосновной, сірководнева кислота обра-зует два ряди солей - сульфіди і гідросульфіди. На відміну від більшості сульфідів, гідросульфіди хо-рошо розчиняються у воді.
Сульфіди і, в меншій мірі гідросульфіди в вод-них розчинах піддаються гідролізу, так як вони про-утворених слабкою кислотою. наприклад:
ся в оксиди, іноді в сульфати, а іноді виділяють сво-Бодня метал.
Деякі сульфіди мають змінний склад. по-
лісульфіди, наприклад, залізо (II) утворює кілька
сульфідів, з яких найбільш важливі FeS (сульфід
заліза) і FeS2 (дисульфід заліза). Пояснюється це тим,
що атоми сірки в складі сульфідів можуть утворювати
між собою ковалентні зв'язки (так звані «сульфідні містки»). Графічна формула FeS2 виглядає наступним чином:
Для натрію відомі полісульфіди змінного со-става від Na2S2 до Na2S5. Якщо до жовтого розчину полі-сульфіду доливати соляну кислоту, відбувається пів-ве розкладання багатосірнисті металів з утворенням третьому H2S і S.
18.3.5. оксиди сірки
Сірка з киснем утворює кілька оксидів, але стійкими є тільки два: SO2 - оксид сірки (IV) і SO3 - оксид сірки (VI). У властивостях цих з'єднань-ний є і схожість, і відмінність.
Як оксиди типового неметалла, вони обидва мають киць-лотний характер, більш виражений у SO3. Але різна ступінь окислення атома сірки в SO2 і SO3 обумовлює істотну відмінність в окислювально-відновник-них властивості цих сполук.
Виявляючи хімічні властивості типових кислотних оксидів, сірчистий і сірчаний ангідрид Взаємодія-ють:
а) з основами, утворюючи два типи солей: кислі і середні.
SO2 + NaOH → NaHSO3 гідросульфіт натрію
SO3 + NaOH → NaHSO4 гидросульфат натрію
б) з основними оксидами
SO2 + CaO → CaSO3 сульфит кальцію
SO3 + CaO → CaSO4 сульфат кальцію
SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
Сірчистий ангідрид. У молекулах SO2 атоми сірки мають проміжну ступінь окислення (+4), тому сірчистий ангідрид поєднує в собі і окислювальну, і відновну здатність, причому остання пре-