Під металами розуміють певну групу елементів, розташовану в лівій частині Періодичної таблиці Д. І. Менделєєва.
Особливість будови металевих речовин полягає в тому, що вони все побудовані в основному з таких атомів, які мають зовнішні електрони слабо пов'язані з ядром. Це обумовлює і особливий характер хімічної взаємодії атомів металу, і металеві властивості.
Теорія металевого стану розглядає метал як речовина, що складається з позитивно заряджених іонів, оточених негативно зарядженими частинками - електронами, слабо пов'язаними з ядром. Ці електрони безперервно переміщаються всередині металу і належать не одному якомусь атому, а всієї сукупності атомів.
Характерною особливістю атомно-кристалічної будови металів є наявність електронного газу всередині металу, слабо пов'язаного з позитивно зарядженими іонами.
Всі метали можна розділити на дві великі групи - чорні і кольорові метали.
Чорні метали мають темно-сірий колір, велику щільність (крім лужноземельних), високу температуру плавлення, відносно високу щільність і в багатьох випадках мають поліморфізмом. Найбільш типовим металом цієї групи є залізо.
Кольорові метали найчастіше мають характерну забарвлення: червону, жовту, білу. Мають великий пластичністю, малою твердістю, відносно низькою температурою плавлення, для них характерна відсутність поліморфізму. Найбільш типовим металом цієї групи є мідь.
Текже метали можна поділити наступним чином:
1. Залізні метали - залізо, кобальт, нікель і близький до них за своїми властивостями марганець. Кобальт, нікель і марганець часто застосовують як добавки до сплавів заліза, а також в якості основи для відповідних сплавів, схожих за своїми властивостями на високолеговані стали.
2. Тугоплавкі метали. температура плавлення яких вище, ніж заліза (тобто 1539 С). Застосовують як добавки до легованих сталей, а також в якості основи для відповідних сплавів.
3. Рідкоземельні метали (РМЗ) - лантан, церій, неодим, празеодим і ін. Об'єднуються під назвою лантаноїдів, і подібні з ними по властивостях ітрій і скандій.
4. Лужноземельні метали у вільному металевому стані не застосовуються, за винятком спеціальних випадків.
Кольорові метали поділяються на:
1. Легкі метали - берилій, магній, алюміній, що володіють малою щільністю.
2. Благородні метали - срібло, золото, метали платинової групи.
3. Легкоплавкие метали - цинк, кадмій, ртуть, олово, свинець, вісмут, талій, сурма і елементи з ослабленими металевими властивостями - галій, германій.
Кристалічна будова металів
Будь-яке речовина може знаходиться в трьох агрегатних станах -твердих, рідкому і газоподібному.
Кристалічний стан перш за все характеризується певним, закономірним розташуванням атомів в просторі.
У кристалі кожен атом має одне і те ж кількість найближчих атомів - сусідів, розташованих на однаковому від нього відстань.
Розташування атомів в кристалі зображується у вигляді просторових схем, у вигляді так званих кристалічних осередків. Під елементарних кристалічних осередком мається на увазі найменший комплекс атомів, який при багаторазовому повторення в просторі дозволяє відтворити просторову кристалічну решітку.
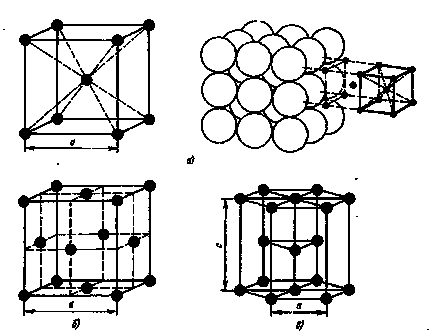
Рис.1. Типи кристалічних осередки:
а - кубічна об'ємно-центрована, б - кубічна гранецентрированная; з - гексагональна щільноупакована
Прагнення атомів металу зайняти місця, найбільш близькі один до одного, призводять до утворення решіток наступних типів (рис. 1): кубічної обсяг-ноцентрірованной, кубічної гранецентрированной і гексагональної плотноупакованной (рис.1).
У кубічної об'ємно-центрованої решітки (ОЦК) атоми розташовані в кутах куба і один атом в центрі обсягу куба. в гранецентрированной кубічної решітці (ГЦК) -атоми розташовані в кутах куба і в центрі кожної грані, в гексагональної решітці атоми розташовані в кутах і центрі шестигранних підстав призми і три атома в середній площині призми.
Кубічну ОЦК решітку мають метали: Na, Li, W, V, Cr і ін. Кубічну ГЦК грати мають Pb, Ni, Ag, Au, Cu і ін.
Розміри кристалічної решітки характеризуються параметрами, або періодами решітки. Кубічну решітку визначає один параметр - довжина ребра куба. Параметри мають величини порядку атомних розмірів і вимірюються в ангстремах.
Деякі метали мають тетрагональную грати; вона характеризується тим, що ребро з не дорівнює ребру а. Ставлення цих параметрів характеризує так звану ступінь тетрагонального. Число атомів, що знаходяться на найбільш близькому відстань від даного атома, називається координаційним числом. Так наприклад, атом в простій кубічної решітці має шість найближчих рівновіддалених сусідів, тобто координаційне число цієї решітки дорівнює 6 (рис. 2).
Центральний атом в об'ємно-центрованої решітці має вісім найближчих рівновіддалених сусідів, тобто координаційне число цієї решітки дорівнює 8. Координаційне число для гранецентрированной решітки одно 12. У разі гексагональної плотноупакованной решітки координаційне число дорівнює 12.