Сутність гідролізу зводиться до обмінного хімічної взаємодії катіонів або аніонів солі з молекулами води. В результаті цієї взаємодії утворюється малодиссоциирующие з'єднання (слабкий електроліт). А у водному розчині солі з'являється надлишок вільних іонів Н + або ОН -. і розчин солі стає кислотним або лужним відповідно.
2. Солі, утворені сильною кислотою і слабкою основою.
Розглянемо гідроліз хлориду амонію NH4 Cl.
У водному розчині солі відбуваються два процеси:
1) незначна оборотна дисоціація молекул води (дуже слабкого амфотерного електроліту), яку спрощено можна записати за допомогою рівняння:
2) повна дисоціація солі (сильного електроліту):
Утворені при цьому іони OH - і NH4 + взаємодіють між собою з отриманням NH3 · H2 O (слабкий електроліт), тоді як іони Н + залишаються в розчині, обумовлюючи тим самим його кислотне середовище.
Повний іонне рівняння гідролізу:
Процес звернемо, хімічна рівновага зміщена в бік утворення вихідних речовин, т. К. Вода Н2 О - значно більш слабкий електроліт, ніж гідроксид амонію NH3 · H2 O.
Скорочена іонне рівняння гідролізу:
Рівняння показує, що:
1) в розчині є вільні іони водню Н +. і їх концентрація більше, ніж в чистій воді, тому розчин солі має кислотну середу (рН <7);
2) в реакції з водою беруть участь катіони амонію NH4 +; в такому випадку говорять, що йде гідроліз по катіону.
В реакції з водою можуть брати участь і багатозарядні катіони: двозарядні М 2+ (наприклад, Ni 2+, Cu 2+. Zn 2+.), Крім катіонів лужноземельних металів, трехзарядние М 3+ (наприклад, Fe 3 +, Al 3 + , Cr 3+.).
Розглянемо гідроліз нітрату нікелю Ni (NO3) 2.
Відбувається гідроліз солі за катіоном Ni 2+.
Повний іонне рівняння гідролізу:
Скорочена іонне рівняння:
Продукти гідролізу - основна сіль NiOHNO3 і азотна кислота HNO3.
Серед водних розчину нітрату нікелю кислотна (рН <7), потому что в растворе увеличивается концентрация ионов Н + .
Гідроліз солі NiOHNO3 протікає в значно меншому ступені, і їм можна знехтувати. Таким чином:
1) по катіону солі, як правило, гідролізуються оборотно;
2) хімічну рівновагу реакцій сильно зміщене вліво;
3) реакція середовища в розчинах таких солей кислотна (рН <7);
4) при гідролізі солей, утворених слабкими многокіслотнимі підставами, виходять основні солі.
3. Солі, утворені слабкою основою і слабкою кислотою.
Такі солі піддаються гідролізу і по катіону, і по аніону.
ЗАПАМ'ЯТАТИ. Можливість і характер протікання гідролізу визначається природою підстави і кислоти, з яких утворена сіль.
Катіон слабкої основи пов'язує іони ОН - з молекул води, утворюючи слабка основа; аніон слабкої кислоти пов'язує іони Н + з молекул води, утворюючи слабку кислоту. Реакція розчинів цих солей може бути нейтральною, слабокислотні або слаболужною. Це залежить від констант дисоціації двох слабких електролітів - кислоти і підстави, які утворюються в результаті гідролізу.
Наприклад, розглянемо гідроліз двох солей: ацетату амонію NH4 CH3 COO і форміату аммоніяNH4 HCCO:
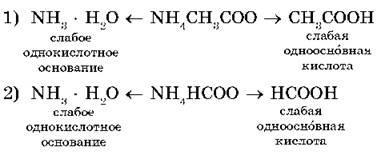
У водних розчинах цих солей катіони слабкої основи NH4 + взаємодіють з гідроксид-іонами ОН - (нагадаємо, що вода дисоціює), а аніони слабких кіслотCH3 COO - і HCOO - взаємодіють з катіонами Н + з утворенням молекул слабких кислот - оцтової CH3 COOH і мурашиної HCOOH.
Запишемо іонні рівняння гідролізу:
У цих випадках гідроліз теж оборотний, але рівновагу зміщений в бік утворення продуктів гідролізу - двох слабких електролітів.
У першому випадку серед розчину нейтральна (рН = 7), т. К. КД (СН3 СООН) = KД (NH3 · H2 O) = 1,8 · 10 -5. У другому випадку серед розчину буде слабокислотні (pH <7), т. к. КД (НСООН) = 2,1 · 10 -4 и KД (NH3 · Н2 О) <КД (НСООН), где КД — константа диссоциации.
Гідроліз більшості солей є оборотним процесом. У стані хімічної рівноваги Гідролізований лише частина солі. Однак деякі солі повністю розкладаються водою, т. Е. Їх гідроліз є незворотнім процесом.
Сульфід алюмінію Al2 S3 в воді піддається необоротного гідролізу, т. К. З'являються при гідролізі по катіону іони Н + зв'язуються утворюються при гідролізі по аниону іонами ОН -. Це підсилює гідроліз і призводить до утворення нерозчинного гідроксиду алюмінію і газоподібного сірководню:
Тому сульфід алюмінію Al2 S3 можна отримати реакцією обміну між водними розчинами двох солей, наприклад, хлориду алюмінію AlCl3 і сульфіду натрію Na2 S.
В результаті гідролізу і по катіону, і по аніону:
1) якщо солі гідролізуються і по катіону, і по аніону оборотно, то хімічна рівновага в реакціях гідролізу зміщене вправо; реакція середовища при цьому або нейтральна, або слабокислотні, або слаболужна, що залежить від співвідношення констант дисоціації які виникають підстави і кислоти;
2) солі можуть гидролизоваться і по катіону, і по аніону необоротно, якщо хоча б один з продуктів гідролізу йде зі сфери реакції.